Les protéines motrices du cytoplasme, un ingrédient anti-âge indispensable à l’autophagie
L’autophagie est un processus cellulaire qui permet de nettoyer la cellule de protéines, de lipides et d’organites défectueux. Ce phénomène fait partie d’un ensemble de mécanismes qui participent tous à la protéostase, c’est-à-dire l’équilibre de tout le réseau de protéines. La perte de la protéostase est une des neuf causes du vieillissement, à l’origine de pathologies liées à l’âge telles que la maladie d’Alzheimer, la maladie de Parkinson ou la cataracte [1]. L’autophagie est efficace grâce à deux types de compartiments cellulaires, les autophagosomes qui emprisonnent et stockent un fragment de cytoplasme à éliminer, puis les lysosomes qui vont détruire le contenu de l’autophagosome. La perte de la capacité autophagique avec l’âge contribue à la perte des capacités fonctionnelles des cellules des organismes âgés [2].
Quel rôle des protéines motrices dans l’autophagie ?
Pour que les lysosomes puissent dégrader le contenu des autophagosomes, il faut que les deux compartiments fusionnent. Cette fusion est possible par leur rencontre dans la cellule, au niveau de la région périnucléaire (au voisinage du noyau) pour la plupart des cas [2]. Afin de se déplacer dans la cellule, les autophagosomes et les lysosomes longent le réseau de microtubules, des petits tubes de tubulines, qui permettent le transport dans le cytoplasme. Ce sont de petites protéines motrices, les plus connues étant les kinésines et les dynéines, qui peuvent, grâce à ce qui ressemble à de petits pieds moléculaires, déplacer les compartiments autophagiques le long des microtubules [3]. Positionner correctement les autophagosomes et les lysosomes dans la même région cellulaire est une étape décisive pour l’accomplissement de l’autophagie. La biogenèse des autophagosomes et leur dégradation par les lysosomes diminue avec l’âge mais les mécanismes sous-jacents à cette atteinte ne sont pas bien connus [2].
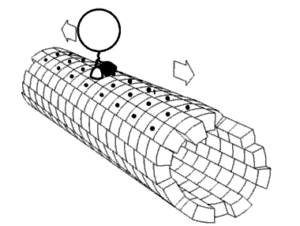
Une équipe franco-américaine de chercheurs a récemment publié les résultats d’une étude [2] menée pour comprendre les phénomènes à l’origine du déclin de l’autophagie associé à l’âge. Ils se sont particulièrement intéressés au positionnement des autophagosomes et des lysosomes au sein de la cellule, en comparant les mouvements de ces organites dans des fibroblastes de souris jeunes (4 mois) et de souris âgées (24 mois). Les chercheurs ont identifié des différences de positionnement de ces compartiments entre cellules jeunes et cellules âgées [2]. Ils se sont ensuite interessé aux causes moléculaires à l’origine de cette différence. En utilisant une approche génétique, les scientifiques ont mimé la faible quantité de KIFC3, une protéine motrice de même rang que les dynéines et interagissant avec les microtubules, tel que retrouvé dans les cellules âgées. Les résultats ont montré qu’un faible niveau de cette protéine entraîne un mauvais positionnement des lysosomes et donc une baisse de la capacité autophagique [2].
Les protéines motrices comme cibles thérapeutiques anti-âge
L’autophagie est un mécanisme de protection des cellules contre la sénescence et la mort cellulaire. Quand l’autophagie est performante, elle lutte contre le vieillissement et elle a été corrélée à la longévité dans de nombreuses études. Néanmoins, avec l’âge, ce phénomène présente un déclin, et les mécanismes moléculaires qui en sont à l’origine sont encore très peu caractérisés. Le positionnement des autophagosomes et des lysosomes à proximité les uns des autres est très important pour permettre leur fusion et la dégradation des composés défectueux. L’étude a permis de montrer qu’un mauvais placement de ces entités dans la même région cellulaire est un phénomène retrouvé avec l’âge. Ce défaut entraîne une baisse de l’efficacité de l’autophagie. La perte du trafic intracellulaire des organites autophagiques serait dû à la baisse du niveau des protéines motrices permettant le déplacement des lysosomes et des autophagosomes le long des microtubules. Cette expérience a identifié les protéines moteurs comme de nouvelles cibles pour de futures thérapies qui auront pour but de corriger la perte de l’autophagie dans la lutte contre le vieillissement et pour la longévité.
Références :
[1] Carlos Lopez-Otin, Maria A. Blasco, Linda Partridge, Manuel Serrano and Guido Kroemer. The Hallmarks of Aging, Cell 153, June 6, 2013, 1194-1217. http://dx.doi.org/10.1016/j.cell.2013.05.039
[2] Bejarano E, Murray JW, Wang X, et al. Defective recruitment of motor proteins to autophagic compartments contributes to autophagic failure in aging. Aging Cell. 2018;e12777. https://doi.org/10.1111/acel.12777
[3] Anna Akhmanova and Michel O. Steinmetz. Control of microtubule organization and dynamics: two ends in the limelight, NATURE REVIEWS | MOLECULAR CELL BIOLOGY VOLUME 16 | DECEMBER 2015, 711-726.
Anne Fischer

Author
Auteur
Anne is studying medicine science at the Institute of Pharmaceutical and Biological Science in Lyon and she has graduated with a Bachelor’s degree in molecular and cellular biology at the University of Strasbourg.
More about the Long Long Life team
Anne étudie les sciences du médicament à l’Institut des Sciences Pharmaceutiques et Biologiques de Lyon. Elle est titulaire d’une licence en biologie moléculaire et cellulaire de l’Université de Strasbourg.
En savoir plus sur l’équipe de Long Long Life















 La protéomique, c’est avant tout une approche multiple, prenant en compte les interactions avec d’autres disciplines, notamment la génomique, et faisant appel à des concepts intercroisés avec l’immunologie, la fonction cellulaire ou la nutrition.
La protéomique, c’est avant tout une approche multiple, prenant en compte les interactions avec d’autres disciplines, notamment la génomique, et faisant appel à des concepts intercroisés avec l’immunologie, la fonction cellulaire ou la nutrition. « Last but not least » comme diraient nos amis anglophones. La métobolomique, c’est la compréhension de réseaux de régulation complexes et la découverte quotidienne de nouveaux acteurs dans les communications entre nos cellules.
« Last but not least » comme diraient nos amis anglophones. La métobolomique, c’est la compréhension de réseaux de régulation complexes et la découverte quotidienne de nouveaux acteurs dans les communications entre nos cellules.