Les thérapeutiques contre la maladie d’Alzheimer : où en sommes-nous ?
La maladie d’Alzheimer est un enjeu de santé publique majeur du fait de l’impact sur les patients et leurs familles, mais aussi par l’absence de traitements efficaces. C’est une maladie qui existe sous deux formes : une génétique, très rare, et une dont l’incidence augmente avec le vieillissement.
Dans tous les cas, elle se caractérise par plusieurs problématiques :
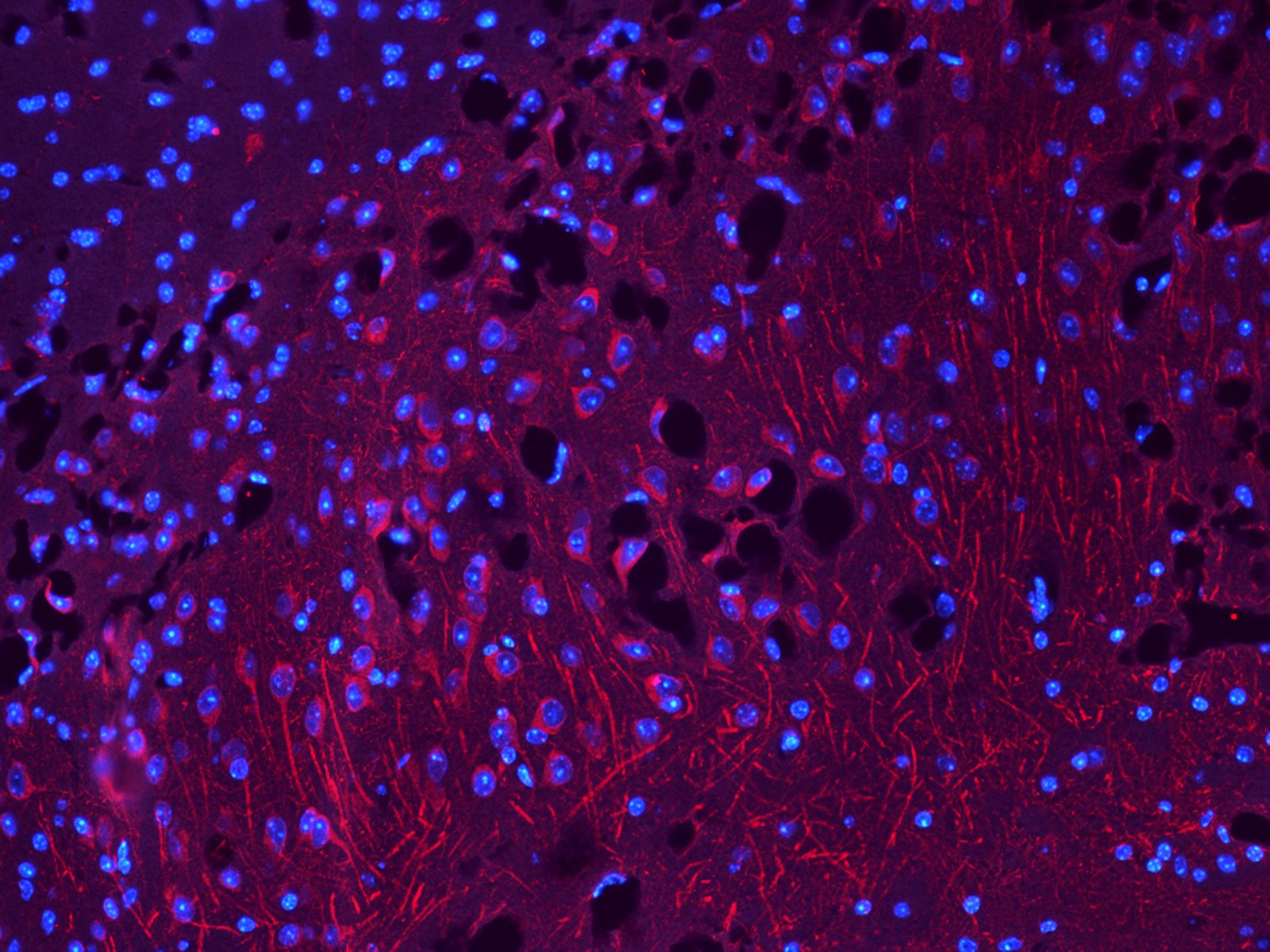
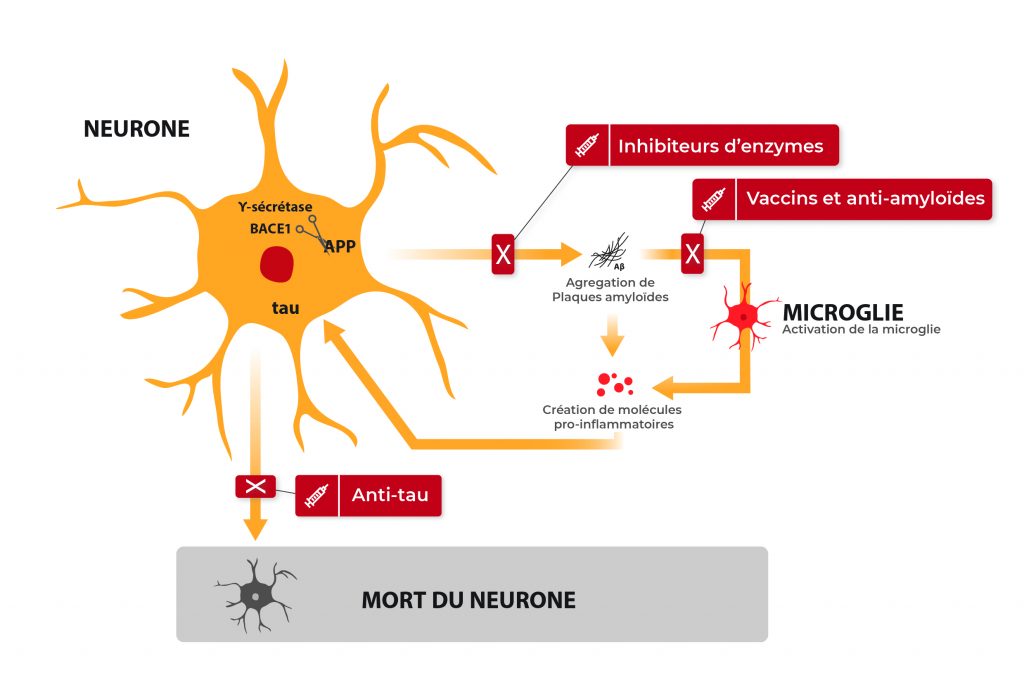
- L’agrégation d’une petite protéine, la bêta-amyloïde également appelée A bêta, sous forme de plaques entre les neurones (les plaques amyloïdes) qui empêchent leur bonne communication,
- L’accumulation de la protéine tau, une protéine fondamentale dans le transport des molécules dans les neurones et dans le maintien de leur armature. Elle est anormalement modifiée par des enzymes ajoutant de petits groupements phosphate en trop grand nombre ,
- L’inflammation en réponse à ces deux anomalies, Elle devient de plus en plus importante avec l’avancée de la maladie et participe à la mort des neurones.
La théorie de la cascade amyloïde, communément acquise actuellement, est la suivante : l’A bêta, lorsqu’elle s’agrège pour former des plaques, déclenche différents signaux délétères, entraine la modification de tau, puis une inflammation, et provoque, à terme, la mort des neurones. C’est alors que les premiers symptômes de la maladie apparaissent, à commencer par des pertes de mémoire, de repères, de la notion de temps… La plupart des patients ne s’inquiètent qu’à partir de ce moment-là, ce qui représente un vrai problème, en l’absence de traitements curatifs.
Plusieurs idées sont aujourd’hui développées pour pallier ce manque.
Les « vaccinations » anti-amyloïde contre la maladie d’Alzheimer
Le terme de vaccination est quelque peu enthousiaste, mais a été adopté par la communauté scientifique et le grand public car le principe de ces thérapies est d’injecter au patient un anticorps, qui va reconnaître l’A bêta et permettre son élimination. Un mécanisme très similaire à ce que nous connaissons de la vaccination. Il s’agit en réalité d’un processus plus complexe, qui peut être actif (1, 2) (nos cellules font le travail et se débarrassent de l’amyloïde) ou passif (3) (le médicament fait le travail et empêche la formation des plaques amyloïdes). C’est une thérapeutique innovante et prometteuse, toujours en cours de développement.
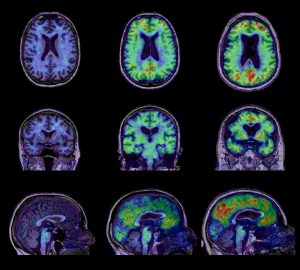
Différences métaboliques et anatomiques entre, de droite à gauche, des contrôles, des patients atteints de démence légère et des patients atteints la maladie d’Alzheimer.
Cependant, les premiers essais cliniques ne semblent pas entièrement concluants (4, 5, 6, 7). Certes, on observe une certaine efficacité à diminuer le nombre de plaques, mais celle-ci ne suffit pas à réduire les symptômes de manière significative. Plusieurs approches sont en cours de développement pour augmenter le rendement de ces vaccins et diminuer leurs effets secondaires.
Les inhibiteurs d’enzymes contre la maladie d’Alzheimer
L’A bêta est un petit peptide issu d’une grande protéine appelée APP. Pour obtenir l’A bêta, l’APP doit être clivé par des enzymes, la gamma-secrétase et la béta-secrétase (aussi appelée BACE-1). Toujours dans l’optique de réduire les plaques amyloïdes, des traitements ont été développés pour diminuer l’activité de ces enzymes et empêcher la formation en amont d’A bêta (8, 9). Les inhibiteurs de gamma-secrétase ont connu un échec retentissant, avec des effets secondaires importants et une dégradation de l’état des patients. Les inhibiteurs de BACE-1 sont encore en phase clinique, les conclusions sont attendues d’ici la fin 2018.
Les anti-tau contre la maladie d’Alzheimer
Une approche similaire aux vaccinations anti-A bêta a été développée, avec pour cible tau, la seconde protéine responsable de la mort des neurones. Beaucoup de ces approches ont été abandonnées suite à des effets secondaires importants ou une efficacité non concluante. Il existe encore un essai thérapeutique en cours (10) dont les résultats sont attendus en 2019.
Une seconde approche a été initiée, se basant sur les propriétés anti-agrégantes d’un médicament précédemment utilisé contre la malaria. Le but de cette thérapeutique est d’empêcher à la protéine tau de s’accumuler dans les neurones et (11). Les résultats sont très bons, bien qu’une amélioration du médicament soit en cours afin de diminuer les effets secondaires observés.
Les anti-inflammatoires contre la maladie d’Alzheimer
L’inflammation est un vrai problème dans la maladie d’Alzheimer : les neurones, lorsqu’ils vont mal, envoient des signaux aux autres cellules qui, en l’absence d’autres solutions, déclenchent une réaction inflammatoire. Le plus souvent, ces réactions sont transitoires et bénéfiques pour le corps. Dans le cerveau d’un malade d’Alzheimer, ce processus commence par une détresse des neurones, est amplifié par la microglie, va s’élargir aux neurones les plus proches qui vont renvoyer des signaux délétères à la microglie, créant ce qu’on appelle un inflammasome : une grosse zone inflammatoire qui s’auto-entretient et qui va participer à la mort des neurones.
Une piste thérapeutique intéressante est donc celle des anti-inflammatoires. Malheureusement, la plupart des pistes ont été abandonnées par manque d’efficacité.
Les pistes un peu plus tordues : l’utilisation d’ultrasons
Il est évident que les anti-amyloïde, les anti-tau et les anti-inflammatoires sont de bons candidats thérapeutiques. Ils sont en accord avec l’hypothèse acquise par la communauté scientifique de la cascade amyloïde (l’A bêta est néfaste, provoque la modification de tau, la mort des neurones et encourage l’inflammation).
Cependant, nous ne savons toujours pas pourquoi l’A bêta décide un jour de former des plaques ou comment notre cerveau arrive à un stade de non-retour et se dit que, finalement, il y a trop de plaques, trop de neurones disparus et qu’il va nous faire oublier des choses. La recherche explore donc des voies alternatives comme les ultrasons.
Lorsque l’A bêta est sous forme de plaques, il est très difficile de s’en débarrasser malgré les efforts de la microglie. Les ultrasons permettent l’ouverture temporaire de la barrière hématoencéphalique : en termes non barbares, ils font vibrer les cellules qui empêchent le passage de grosses molécules dans notre cerveau et les obligent à se rétracter pendant quelques secondes. Ce faisant, les plaques amyloïdes peuvent passer cette barrière et être éliminées (12). Quelques sessions d’ultrasons et le cerveau est presque vierge de plaques et les améliorations cognitives sont flagrantes ! Les essais sont encore au stade animal, mais sont très encourageants et offriraient une alternative non médicamenteuse.
Il serait trop long de parcourir toutes les voies et toutes les recherches en cours, mais rassurez-vous, nous touchons au but ! Si vous souhaitez en savoir plus sur les traitements en cours de développement, allez faire un tour sur AlzForum, un site dédié à la maladie d’Alzheimer (en anglais)
http://www.alzforum.org/therapeutics
Vous pouvez aussi vous renseigner sur les sites des fondations de lutte contre Alzheimer (en français), comme France Alzheimer ou LECMA/Vaincre Alzheimer.
Dr. Marion Tible

Author/Reviewer
Auteure/Relectrice
Marion Tible has a PhD in cellular biology and physiopathology. Formerly a researcher in thematics varying from cardiology to neurodegenerative diseases, she is now part of Long Long Life team and is involved in scientific writing and anti-aging research.
More about the Long Long Life team
Marion Tible est docteur en biologie cellulaire et physiopathologie. Ancienne chercheuse dans des thématiques oscillant de la cardiologie aux maladies neurodégénératives, elle est aujourd’hui impliquée au sein de Long Long Life pour la rédaction scientifique et la recherche contre le vieillissement.
En savoir plus sur l’équipe de Long Long Life
- Pride M, Seubert P, Grundman M, Hagen M, Eldridge J, Black RS. Progress in the active immunotherapeutic approach to Alzheimer’s disease: clinical investigations into AN1792-associated meningoencephalitis. Neurodegener Dis. 2008;5:194–196.
- Hock C, Konietzko U, Paspassotiropoulos A, Wollmer A, Streffer J, von Rotz RC, Davey G, Moritz E, Nitsch RM. Generation of antibodies specific for β-amyloid by vaccination of patients with Alzheimer disease. Nat Med. 2002;8:1270–1276.
- Abdelrahman Ibrahim Abushouk, Ahmed Elmaraezy, Amro Aglan, Reham Salama, Samar Fouda, Rana Fouda, and Ammar M. AlSafadi Bapineuzumab for mild to moderate Alzheimer’s disease: a meta-analysis of randomized controlled trials. BMC Neurol. 2017; 17: 66.
- Wisniewski T. Practice point commentary on “Clinical effects of Aβ immunization (AN1792) in patients with AD in an interrupted trial. Nat Clin Prac Neurol. 2005;1:84–85
- Ferrer I, Boada RM, Sanchez Guerra ML, Rey MJ, Costa-Jussa F. Neuropathology and pathogenesis of encephalitis following amyloid-beta immunization in Alzheimer’s disease. Brain Pathol. 2004;14:11–20
- Nicoll JA, Wilkinson D, Holmes C, Steart P, Markham H, Weller RO. Neuropathology of human Alzheimer disease after immunization with amyloid-beta peptide: a case report. Nat Med. 2005;9:448–452.
- Michael Gold Phase II clinical trials of anti–amyloid β antibodies: When is enough, enough? Alzheimer’s Dement (N Y). 2017 Sep; 3(3): 402–409
- Kennedy ME, Stamford AW, Chen X, Cox K, Cumming JN, Dockendorf MF, Egan M, Ereshefsky L, Hodgson RA, Hyde LA, Jhee S, Kleijn HJ, Kuvelkar R, Li W, Mattson BA, Mei H, Palcza J, Scott JD, Tanen M, Troyer MD, Tseng JL, Stone JA, Parker EM, Forman MS. The BACE1 inhibitor verubecestat (MK-8931) reduces CNS β-amyloid in animal models and in Alzheimer’s disease patients. Sci Transl Med. 2016 Nov 2;8(363):363ra150
- Coric V, van Dyck CH, Salloway S, Andreasen N, Brody M, Richter RW, Soininen H, Thein S, Shiovitz T, Pilcher G, Colby S, Rollin L, Dockens R, Pachai C, Portelius E, Andreasson U, Blennow K, Soares H, Albright C, Feldman HH, Berman RM. Safety and Tolerability of the γ-Secretase Inhibitor Avagacestat in a Phase 2 Study of Mild to Moderate Alzheimer Disease. Arch Neurol. 2012 Aug 13;:1-12.
- Kontsekova E, Zilka N, Kovacech B, Novak P, Novak M. First-in-man tau vaccine targeting structural determinants essential for pathological tau-tau interaction reduces tau oligomerisation and neurofibrillary degeneration in an Alzheimer’s disease model. Alzheimers Res Ther. 2014;6(4):44.
- Wischik CM, Staff RT, Wischik DJ, Bentham P, Murray AD, Storey JM, Kook KA, Harrington CR. Tau aggregation inhibitor therapy: an exploratory phase 2 study in mild or moderate Alzheimer’s disease. J Alzheimers Dis. 2015;44(2):705-20.
- Leinenga G, Götz J. Scanning ultrasound removes amyloid-β and restores memory in an Alzheimer’s disease mouse model. Sci Transl Med. 2015 Mar 11;7(278).