Stress et vieillissement prématuré: l’environnement social mis en cause
Nous connaissons tous les désagréments entraînés par un environnement social stressant: mal-être, fatigue, perte d’appétit… Et si le stress allait encore plus loin? C’est ce que suggère une étude parue dans Aging Cell cette année [1]. L’équipe d’Alessandro Bartolomucci, de l’Université du Minnesota, y montre que des souris soumises à des agressions de la part de leurs congénères tout au long de leur vie vivent moins longtemps. Plus encore, ils observent qu’elles souffrent davantage de maladies cardiovasculaires.
Souris dominantes ou subordonnées: quand le stress impacte la longévité
Le stress social est facilement définissable chez l’homme, mais comment le reproduire chez la souris? Et comment être sûr de le maintenir en permanence? De ne mesurer que ses effets propres?
Pour répondre à ces questions, les chercheurs utilisent des souris d’une même famille dans un dispositif ingénieux. Les souris étudiées sont introduites dans l’habitat d’autres souris, qui leurs sont inconnues, créant ainsi des tensions entre individus. Bien que séparées par une grille, elles sont en contact direct 10 minutes par jour. Les chercheurs comptent alors le nombre d’agressions perpétrées et subies par leurs souris d’intérêt. Ils identifient différents comportements chez leurs souris: celles qui subissent de nombreuses agressions de la part des souris résidentes et celles qui, au contraire, agressent les résidentes sans l’être en retour. Les premières sont qualifiées de subordonnées, soumises à un fort stress social, et les secondes de dominantes, n’en subissant pas.
En comparant ces deux groupes, ils remarquent alors une différence frappante. La longévité et la probabilité de survie à partir d’un certain âge est plus faible chez les souris dominées. Mais pour quelles raisons?
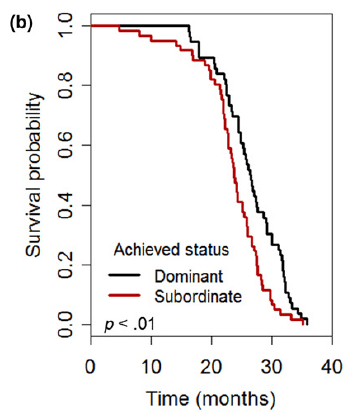
Vieillir plus vite et en moins bonne santé à cause du stress
Curieux d’éclaircir les caractéristiques de ce vieillissement prématuré, les chercheurs étudient alors l’état de santé de leurs souris. Ils remarquent tout d’abord qu’à régime alimentaire égal, les souris dominées possèdent un taux de glucose sanguin plus élevé et grossissent plus.
Ce phénomène s’accompagne également d’une apparition prématurée, comparée aux souris dominantes, de lésions dues à l’âge sur la plupart de leurs organes. Le foie et la rate sont les plus touchés et les auteurs se sont intéressés à la sénescence des cellules dans ces organes. En étudiant des gènes spécifiques de ce mécanisme, il ont pu arriver à la conclusion que la sénescence était en effet la cause probable de la dysfonction du foie et de la rate. Cette découverte implique que le stress induirait une sénescence importante provoquant le vieillissement prématuré des souris.
La liste ne s’arrête pas là ! Les chercheurs observent également que les souris dominées développent de l’athérosclérose lorsqu’elles ont encore jeunes. Ce phénomène, caractérisé par un épaississement et une perte d’élasticité des artères, est normalement associée à un âge avancé. Il est dû au dépôt de graisse sur la paroi des artères et peut résulter en la rupture de celles-ci. On peut donc, d’après cette étude, lier le stress à la prise de poids mais également à l’augmentation des risques cardiovasculaires.

Ainsi, le stress social entraînerait chez la souris un vieillissement accéléré des organes, du système cardiovasculaire, le tout associé à une mauvaise santé. Ces résultats semblent montrer une chose: prendre du temps pour soi et se détendre au quotidien ne serait peut être pas qu’un luxe, cela pourrait également être un outil pour vivre mieux et plus longtemps.
Références:
[1] Razzoli M, Nyuyki‐Dufe K, Gurney A, et al. Social stress shortens lifespan in mice. Aging Cell. 2018;17:e12778. https://doi.org/10.1111/acel.12778
Baptiste Tesson

Author
Auteur
Baptiste is studying biology at the École Normale Supérieure de Lyon and bioengineering at the École Polytechnique Fédérale de Lausanne. He worked on the optimization of Cas9 as a tool for genome editing and on the emergence of blood stem cells in the zebrafish. He currently works on the patterning of the muscles, also in the zebrafish. He plans on doing a PhD in developmental biology.
More about the Long Long Life team
Baptiste étudie la biologie à l’École Normale Supérieure de Lyon et la bioingénierie à l’École Polytechnique Fédérale de Lausanne. Il a travaillé sur l’optimisation de la protéine Cas9 comme outil de modification de génomes et sur le développement des cellules souches du sang chez le poisson zèbre et travaille actuellement sur la mise en place des muscles chez le même animal. Il projette de réaliser un doctorat axé vers le développement animal.
En savoir plus sur l’équipe de Long Long Life
















 La protéomique, c’est avant tout une approche multiple, prenant en compte les interactions avec d’autres disciplines, notamment la génomique, et faisant appel à des concepts intercroisés avec l’immunologie, la fonction cellulaire ou la nutrition.
La protéomique, c’est avant tout une approche multiple, prenant en compte les interactions avec d’autres disciplines, notamment la génomique, et faisant appel à des concepts intercroisés avec l’immunologie, la fonction cellulaire ou la nutrition. « Last but not least » comme diraient nos amis anglophones. La métobolomique, c’est la compréhension de réseaux de régulation complexes et la découverte quotidienne de nouveaux acteurs dans les communications entre nos cellules.
« Last but not least » comme diraient nos amis anglophones. La métobolomique, c’est la compréhension de réseaux de régulation complexes et la découverte quotidienne de nouveaux acteurs dans les communications entre nos cellules.