Fight Aging! Extraits
Parce que tout le monde ne comprend pas forcément la langue de Shakespeare, Long Long Life vous fournit une traduction automatique post-éditée des éléments les plus importants de la newsletter Fight Aging!
Fight Aging! fournit un résumé hebdomadaire des actualités et des commentaires pour des milliers d’abonnés intéressés par la science de la longévité: progrès en matière de contrôle médical du vieillissement afin de prévenir la vulnérabilité, la souffrance et les maladies liées à l’âge, ainsi que pour fournir des améliorations dans la compréhension actuelle de ce qui fonctionne et ce qui ne fonctionne pas lorsqu’il s’agit de prolonger une vie saine. Attendez-vous à voir des résumés des récents progrès de la recherche médicale, des nouvelles de la communauté scientifique, des initiatives de collecte de fonds pour accélérer le travail sur la réparation et l’inversion du vieillissement, des liens vers des ressources en ligne, et bien plus encore.
Ce contenu est publié sous la licence Creative Commons Paternité 4.0 International License. Nous vous encourageons à le republier et à le réécrire comme bon vous semble, la seule condition étant de fournir une attribution et un lien vers Fight Aging!
Pour vous abonner ou vous désabonner, veuillez visiter le site de Fight Aging!: https://www.fightaging.org/newsletter/
Extraits de Fight Aging! :
- Un ensemble de sénolytiques marginaux et présumés ne présentent aucun avantage significatif dans une étude sur les cellules
- Comportement des cellules gliales critique pour une régénération efficace du système nerveux central
- Vers une meilleure horloge épigénétique
- L’exercice augmente la fréquence à laquelle les nouvelles cellules cardiaques sont produites
- Le déclin du système immunitaire détermine-t-il la contribution des cellules sénescentes au vieillissement ?
Un ensemble de sénolytiques marginaux et présumés ne présentent aucun avantage significatif dans une étude sur les cellules
Les composés sénolytiques sont ceux qui détruisent sélectivement les cellules sénescentes. Comme l’accumulation de cellules sénescentes est l’une des causes profondes du vieillissement et que les cellules sénescentes contribuent directement à de nombreuses maladies spécifiques liées à l’âge, il existe un certain intérêt pour le développement de sénolytiques efficaces. Comme c’est le cas pour tout domaine du développement médical, il y a autant de médicaments sénolytiques marginaux et possibles qu’il y a de médicaments sénolytiques utiles et éprouvés. L’ampleur de l’effet, la nature des effets secondaires et la qualité de la preuve sont très importants – en fait, il s’agit de l’ensemble du débat sur la viabilité ou non d’un composé particulier.
Les chercheurs rapportent ici quelques sénolytiques marginaux et les possibles, comparés à la navitoclax, et n’ont observé aucun effet utile dans une étude cellulaire. Il s’agit d’un travail de confirmation utile, même si l’on peut s’attendre à des résultats basés sur des preuves passées, en particulier pour la quercétine. Cela dit, il est important de noter que différents types de cellules sénescentes ont montré des degrés très différents de vulnérabilité à diverses classes de sénolytiques. Ce n’est pas aussi simple que l’échec dans un type de cellule disqualifiant complètement un sénolytique potentiel, mais plutôt une considération de la balance des preuves provenant d’études multiples.
Les médicaments sénolytiques ont la perspective de cibler spécifiquement les cellules sénescentes et donc de rajeunir les tissus ou les organismes. Plusieurs composés ont été suggérés pour posséder des effets sénolytiques, y compris la navitoclax (ABT-263), la quercétine, le danazol et le riboside de nicotinamide. ABT-263 inhibe les membres de la famille des protéines BCL-2, qui sont des régulateurs cruciaux de la voie de l’apoptose. Il a été démontré que l’ABT-263 épuise les cellules sénescentes des cellules épithéliales des veines ombilicales humaines (HUVECs), des fibroblastes pulmonaires humains IMR90 et des fibroblastes embryonnaires murins, mais pas les pré-adipocytes primaires humains. Le danazol est un androgène synthétique à capacité d’élongation télomérique, qui a été utilisé pour cibler l’attrition accélérée des télomères – une caractéristique du vieillissement et de la sénescence. La quercétine est un activateur de protéasome aux propriétés anti-oxydantes qui déclenche l’apoptose par la voie BCL-2. Le riboside de nicotinamide augmente les niveaux de nicotinamide adénine dinucléotide (NAD+). Des souris âgées supplémentées en riboside de nicotinamide ont révélé une augmentation de la durée de vie et des cellules souches musculaires rajeunies.
Les cellules primaires subissent un nombre limité de divisions avant d’entrer dans l’état de sénescence réplicative. Le processus de sénescence induit des changements dans la morphologie, le métabolisme, le phénotype sécrétoire et le potentiel de différenciation des cellules, ce qui a un impact significatif sur les résultats expérimentaux et affecte leur potentiel thérapeutique. Cela s’applique particulièrement aux cellules stromales mésenchymateuses (CSM), qui suscitent de grands espoirs dans le génie tissulaire et sont simultanément testées dans une multitude d’essais cliniques. Les CSM comprennent un sous-ensemble multipotent de cellules, capable de se différencier vers des lignées ostéogéniques, chondrogéniques et adipogènes. L’élimination sélective des MSC sénescentes des cultures pourrait améliorer la standardisation et l’efficacité des préparations cellulaires pour la thérapeutique cellulaire en médecine régénérative. Nous avons donc directement comparé la capacité sénolytique de l’ABT-263, de la quercétine, du danazol et du riboside de nicotinamide dans les CSM humaines au cours d’une culture à long terme.
Les effets de ces composés ont été analysés lors de l’expansion à long terme des CSM, jusqu’à la sénescence réplicative. De plus, nous avons déterminé l’effet sur les marqueurs moléculaires de la sénescence réplicative, comme la coloration de la bêta-galactosidase associée à la sénescence (SA-β-gal), l’attrition du télomère et les changements de méthylation de l’ADN associé à la sénescence. Les expériences ont révélé que l’ABT-263 avait un effet sénolytique significatif mais modéré. Ceci était conforme à la réduction de la coloration SA-β-gal dans les CSM sénescentes lors d’un traitement par ABT-263. Cependant, aucun des médicaments n’a eu d’effets significatifs sur le nombre maximum de doublons de population, la longueur des télomères ou les prédictions de sénescence épigénétique. Des quatre médicaments testés, seul l’ABT-263 a révélé un effet sénolytique chez les CSM humaines – et même le traitement avec ce composé n’a pas rajeuni les CSM en ce qui concerne la longueur du télomère ou la signature épigénétique de la sénescence. Il sera important d’identifier des médicaments sénolytiques plus puissants pour répondre aux grands espoirs de la médecine régénérative.
Comportement des cellules gliales critique pour une régénération efficace du système nerveux central
Pourquoi des espèces comme la salamandre peuvent-elles faire repousser des organes et des membres alors que les mammifères ne le peuvent pas ? Cette compétence s’étend même à des parties du système nerveux central, comme la moelle épinière. Au cours des dernières années, les chercheurs ont fait de grands progrès dans la compréhension de la régénération exceptionnelle et ont découvert que, par exemple, les différences dans le comportement des cellules immunitaires appelées macrophages sont essentielles à la repousse. Dans le système nerveux central, les cellules gliales sont quelque peu analogues aux macrophages dans d’autres tissus, et dans la recherche mentionnée ici, les scientifiques rapportent des preuves d’une importance équivalente dans les capacités régénératives des mammifères par rapport à celles des salamandres.
Étant donné la connexion entre les macrophages et les cellules gliales, ce domaine de la biologie comparative est en train de passer de spéculatif à pertinent pour le développement clinique. De nombreux groupes de recherche étudient l’altération du comportement des macrophages et des cellules gliales afin de stimuler une plus grande régénération chez les mammifères. Ces cellules peuvent être classées selon leur comportement, soit agressif et inflammatoire tout en recherchant des pathogènes, soit plus axé sur l’aide à la régénération. Les deux comportements sont nécessaires, mais chez les mammifères, et chez les personnes âgées, il y a trop du premier type et trop peu du second type de comportement. En apprenant à ajuster le comportement des cellules pour changer ce déséquilibre, on peut jeter les bases d’améliorations plus profondes de la régénération dans les années à venir, en s’appuyant sur ce que l’on apprend des salamandres.
L’un des problèmes les plus troublants des lésions de la moelle épinière est que le corps humain ne reconstruit pas les nerfs une fois qu’ils ont été endommagés. D’autres animaux, par contre, semblent n’avoir aucun problème à réparer les neurones brisés. Les chercheurs ont étudié un amphibien connu sous le nom d’axolotl ou salamandre mexicaine. Les axolotls élevés en captivité sont fréquemment utilisés dans la recherche biologique, à la fois pour apprendre de la remarquable capacité de l’animal à régénérer des parties du corps et pour aider à éclairer les efforts de conservation.
Lorsqu’un axolotl souffre d’une lésion de la moelle épinière, les cellules gliales voisines passent à la vitesse supérieure, prolifèrent rapidement et se repositionnent pour reconstruire les connexions entre les nerfs et reconnecter la moelle épinière blessée. Par contre, lorsqu’un humain souffre d’une lésion de la moelle épinière, les cellules gliales forment un tissu cicatriciel qui empêche les nerfs de se reconnecter entre eux.
Les chercheurs ont retracé les mécanismes moléculaires à l’œuvre dans chaque cas. Ils ont découvert qu’une protéine particulière appelée c-Fos, qui affecte l’expression génétique, est essentielle aux processus que les axolotls utilisent pour réparer les nerfs blessés. Alors que les humains ont également c-Fos, chez les humains, la protéine fonctionne de concert avec d’autres protéines, dans la famille JUN, qui provoquent une gliose réactive des cellules, ce qui conduit à la formation de cicatrices. Dans les axolotls, ce circuit moléculaire est soigneusement régulé pour diriger les cellules gliales axolotl vers une réponse régénératrice.
« Notre approche nous permet d’identifier non seulement les mécanismes nécessaires à la régénération des salamandres, mais aussi ce qui se passe différemment chez l’homme dans les reprises de blessures. En plus de la régénération de la moelle épinière, notre travail se concentre également sur d’autres formes de régénération, y compris la cicatrisation sans cicatrices et la régénération des membres ».

Vers une meilleure horloge épigénétique
Les chercheurs rapportent ici une version améliorée de l’horloge épigénétique. Quelques modèles soigneusement définis de méthylation de l’ADN, y compris l’horloge épigénétique originale, sont en corrélation assez étroite avec l’âge. La mise en œuvre commerciale actuelle de l’horloge épigénétique, MyDNAge, a une marge d’erreur d’environ deux ans. Bien que le consensus soit que l’horloge reflète l’âge biologique, il n’en demeure pas moins que l’on peut se demander ce que l’on mesure exactement. La réponse à cette question reste à établir. Il est plausible que les changements de méthylation de l’ADN avec l’âge sont une réaction à toutes les formes de dommages cellulaires et tissulaires qui entraînent le vieillissement, mais cela n’est nullement certain – cela pourrait être plus spécifique que cela, lié seulement à certaines des causes du vieillissement.
L’un des principaux objectifs de la recherche géroscientifique est de définir les » biomarqueurs du vieillissement « , que l’on peut considérer comme des mesures individuelles du vieillissement qui saisissent les différences interindividuelles dans le moment de l’apparition de la maladie, le déclin fonctionnel et la mort au cours de la vie. Bien que l’âge chronologique soit sans doute le facteur de risque le plus important pour les décès et les maladies liés au vieillissement, il est important de distinguer le temps chronologique du vieillissement biologique. Les individus d’un même âge chronologique peuvent présenter des susceptibilités très différentes aux maladies liées à l’âge et à la mort, ce qui reflète probablement des différences dans leurs processus sous-jacents de vieillissement biologique. De tels biomarqueurs du vieillissement seront cruciaux pour permettre l’évaluation des interventions visant à promouvoir un vieillissement plus sain, en fournissant un résultat mesurable qui, contrairement à l’incidence des décès et/ou des maladies, n’exige pas d’observation de suivi extrêmement longue.
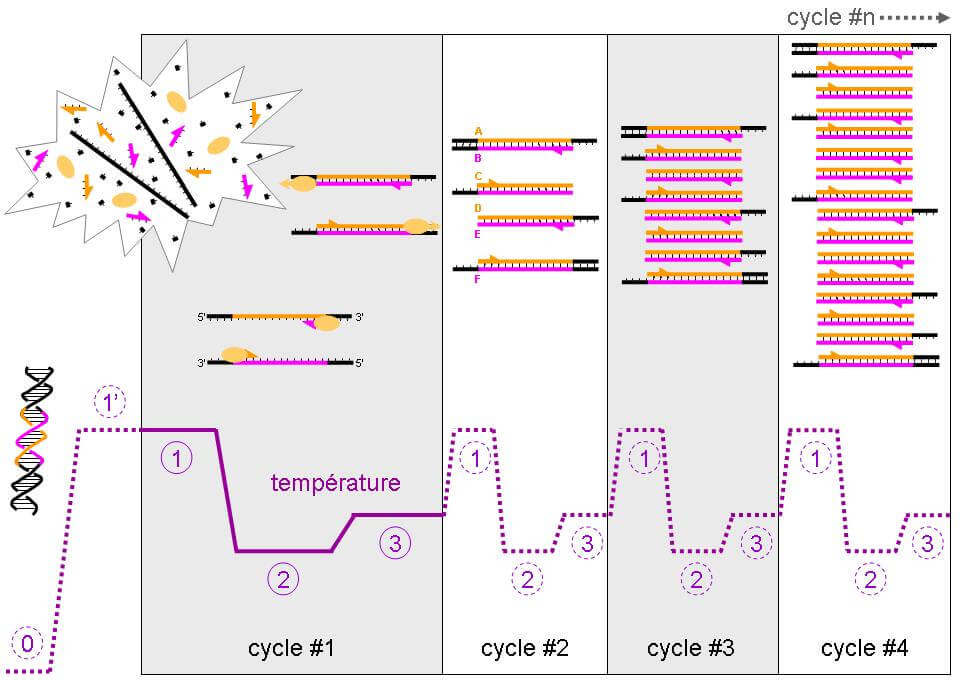
La méthylation de l’ADN (DNAm) est un biomarqueur potentiel qui a suscité beaucoup d’intérêt au cours des dernières années. Il a été démontré que le temps chronologique provoque des changements prévisibles d’hypo- et d’hyperméthylation dans de nombreuses régions du génome et, par conséquent, la première génération de biomarqueurs du vieillissement basés sur l’ADNm a été mise au point pour prédire l’âge chronologique. L’algorithme basé sur le sang de Hannum et l’algorithme multi-tissus de Horvath produisent des estimations d’âge (âge ADNm) qui correspondent à l’âge chronologique pour les échantillons de toute la gamme d’âge. Néanmoins, bien que les estimateurs actuels de l’âge épigénétique présentent des associations statistiquement significatives avec de nombreuses maladies et affections liées à l’âge, l’ampleur de l’effet est généralement faible à modérée. Une explication est que l’utilisation de l’âge chronologique comme référence, par définition, peut exclure les sites CpG dont les schémas de méthylation ne présentent pas de fortes variations en fonction du temps, mais signalent plutôt le départ de l’âge biologique de l’âge chronologique. Il est donc important de saisir non seulement les sites CpG qui affichent des changements avec le temps chronologique, mais aussi ceux qui tiennent compte des différences de risque et d’état physiologique entre les individus d’un même âge chronologique.
Des travaux antérieurs par nous et d’autres ont montré que les » mesures du vieillissement phénotypique « , dérivées de biomarqueurs cliniques, prédisent fortement les différences dans le risque de mortalité toutes causes confondues, la mortalité par cause spécifique, le fonctionnement physique, les mesures de performance cognitive et le vieillissement facial chez les personnes du même âge. Qui plus est, dans les données représentatives de la population, certaines de ces mesures se sont révélées être de meilleurs indicateurs de l’espérance de vie restante que l’âge chronologique, ce qui donne à penser qu’elles peuvent être une approximation des différences individuelles dans les taux de vieillissement biologique. Par conséquent, nous émettons l’hypothèse qu’un biomarqueur épigénétique plus puissant du vieillissement pourrait être développé en remplaçant la prédiction de l’âge chronologique par la prédiction d’une mesure de substitution de l' »âge phénotypique » qui, en soi, différencie le risque de morbidité et de mortalité chez les personnes du même âge.
En utilisant une nouvelle méthode en deux étapes, nous avons réussi à développer un biomarqueur du vieillissement basé sur l’ADNm qui est hautement prédictif de presque tous les résultats de morbidité et de mortalité que nous avons testés. La formation d’un prédicteur épigénétique de l’âge phénotypique au lieu de l’âge chronologique a permis d’améliorer considérablement les prévisions de mortalité et d’espérance de vie par rapport à la première génération de biomarqueurs d’âge chronologique basés sur l’ADNm. Il s’agit de la première étude à démontrer de façon concluante que les biomarqueurs du vieillissement de l’ADNm sont hautement prédictifs des maladies cardiovasculaires et coronariennes. La nouvelle mesure, DNAm PhenoAge, suit également l’âge chronologique et se rapporte au risque de maladie dans les échantillons autres que le sang total. Enfin, nous constatons que le PhénoAge ADNm d’un individu, par rapport à son âge chronologique, est modérément héréditaire et est associé à l’activation de la pro-inflammatoire, l’interféron, la réparation des dommages à l’ADN, la signalisation transcriptionnelle/translationnelle, et divers marqueurs de l’immunosénescence : un déclin des cellules T naïves et une longueur de télomère leucocytaire raccourcie.
L’exercice augmente la fréquence à laquelle les nouvelles cellules cardiaques sont produites
Pour faire suite à l’ensemble des recherches sur l’exercice d’hier, voici une note intéressante sur les effets de l’exercice sur la base de l’entretien des tissus cardiaques. Le cœur est l’un des organes les moins régénératifs chez les mammifères, incapable de se réparer à un degré significatif à la suite d’une blessure. Néanmoins, à l’intérieur de ces limites limitées, l’exercice peut faire une différence considérable. Cela est corroboré par les données probantes montrant que les patients atteints d’une maladie cardiaque ont un meilleur pronostic lorsqu’ils maintiennent un programme d’exercice, même dans une moindre mesure qu’ils sont capables de le maintenir.
Dans une nouvelle étude réalisée chez la souris, les chercheurs ont découvert une explication pour expliquer pourquoi l’exercice pourrait être bénéfique : il stimule le cœur, pour produire de nouvelles cellules musculaires, à la fois dans des conditions normales et après une crise cardiaque. Le cœur humain a une capacité relativement faible à se régénérer. Les jeunes adultes peuvent renouveler environ 1 % de leurs cellules musculaires cardiaques chaque année, et ce taux diminue avec l’âge. La perte de ces cellules est liée à l’insuffisance cardiaque, de sorte que les interventions qui augmentent la formation de cellules ont le potentiel d’aider à la prévenir.
« Nous voulions savoir s’il existe un moyen naturel d’améliorer la capacité de régénération des cellules du muscle cardiaque. Nous avons donc décidé de tester la seule intervention que nous savons déjà sûre et peu coûteuse : l’exercice. » Pour tester ses effets, les chercheurs ont donné à un groupe de souris en bonne santé l’accès volontaire à un tapis roulant. Laissées seules, les souris couraient environ 5 kilomètres par jour. L’autre groupe en bonne santé n’avait pas les privilèges d’un tel gymnase et restait sédentaire.
Pour mesurer la régénération cardiaque dans les groupes de souris, les chercheurs ont administré un produit chimique marqué qui a été incorporé dans de l’ADN nouvellement fabriqué alors que les cellules se préparaient à se diviser. En suivant l’ADN marqué dans le muscle cardiaque, les chercheurs pouvaient voir où les cellules étaient produites. Ils ont découvert que les souris qui faisaient de l’exercice fabriquaient plus de 4,5 fois le nombre de nouvelles cellules du muscle cardiaque, tout comme les souris sans tapis roulant. Après avoir subi une crise cardiaque, les souris ayant accès à un tapis roulant couraient encore 5 kilomètres par jour, volontairement. Par rapport à leurs homologues sédentaires, les souris en exercice ont montré une augmentation de la surface du tissu cardiaque où de nouvelles cellules musculaires sont fabriquées. Les chercheurs ont maintenant l’intention de déterminer quels mécanismes biologiques lient l’exercice à une activité régénératrice accrue dans le cœur.

Le déclin du système immunitaire détermine-t-il la contribution des cellules sénescentes au vieillissement ?
La rumeur d’auto-expérimentation veut que les produits pharmaceutiques sénolytiques actuellement disponibles, les produits chimiothérapeutiques réorientés qui peuvent détruire sélectivement une fraction des cellules sénescentes, peuvent montrer des résultats pour des conditions inflammatoires chez les personnes âgées. De même, ils ne semblent pas produire d’avantages évidents chez les personnes de 40 ans et plus en bonne santé. Si les cellules sénescentes sont effectivement une source d’inflammation chronique, il ne faut jamais agir selon des rumeurs : il faut patienter jusqu’à ce que les données des études cliniques actuelles ou à venir soient publiées et validées. Nous pouvons certainement débattre et émettre des hypothèses, cependant, lorsque des anecdotes chevauchent des données existantes sur les animaux et des preuves à l’appui provenant d’autres axes de recherche.
Mon raisonnement est le suivant : le système immunitaire est responsable de la destruction des cellules cancéreuses et des cellules sénescentes qui ne parviennent pas à s’autodétruire. Les cellules immunitaires sont très efficaces lorsqu’il s’agit de cette tâche et, par conséquent, le risque posé par ces deux classes de cellules nocives demeure faible pendant une grande partie de la vie. C’est le cas jusqu’à ce que la fonction immunitaire ait diminué de façon significative avec l’âge ; on peut regarder les modèles qui mettent en corrélation le risque de cancer avec l’atrophie du thymus, et donc la réduction de la génération des cellules T, par exemple. Il s’adapte bien. Le pic du risque de cancer se situe entre 60 et 80 ans, ce qui est aussi, plus ou moins, là où l’on commence à voir l’incidence des affections inflammatoires liées à l’âge liées à la sénescence cellulaire augmenter considérablement.
Personne n’a encore mené les études nécessaires pour dresser un tableau décent de la charge cellulaire sénescente selon l’âge. Je parie que lorsque cela sera fait, les chiffres refléteront de près le risque de cancer et la perte de la fonction immunitaire. Certains chercheurs réfléchissent en ce sens depuis un certain temps déjà, et j’ai remarqué ce commentaire au milieu d’une récente entrevue menée par les bénévoles de la Life Extension Advocacy Foundation :
La recherche suggère que l' »inflammation » joue un rôle clé dans le vieillissement ; de nombreuses publications suggèrent également que parmi les diverses sources de cette inflammation chronique liée à l’âge, l’accumulation de cellules sénescentes et le phénotype sécrétoire associé à la sénescence qu’elle produit est le principal coupable. Que peut-on s’attendre à voir si des thérapies visant à éliminer ces cellules problématiques sont utilisées chez les gens ?
J’ai un point de vue différent de celui de la majorité. J’étais l’un des grands fans des cellules sénescentes, et j’étais inspiré à 100% par l’idée de les trouver, de les éradiquer et de les utiliser pour le rajeunissement. Cependant, après avoir passé plusieurs années très concentrées sur une étude approfondie des cellules sénescentes in vivo, nous nous sommes rendu compte que pour une grande partie de la durée de vie de la souris, nous ne pouvons tout simplement pas trouver ces cellules. Ce n’est pas parce que celles-ci n’existent pas ; je pense qu’elles apparaissent assez fréquemment au cours de notre vie et de celle des souris, mais elles sont très efficacement éradiquées par le système immunitaire.
Que les changements dans l’inflammation in vivo avec l’âge soient dus à l’activité des cellules sénescentes est une grande question, car lorsque nous avons essayé de trouver ces cellules dans, par exemple, un organisme irradié, la plupart des cellules que les gens pensaient être sénescentes avant l’existence des biomarqueurs conventionnels semblaient n’être que des parties du système immunitaire, qui dysfonctionne avec le vieillissement et a créé l’apparence des cellules sénescentes. Les macrophages deviennent souvent positifs pour les biomarqueurs des cellules sénescentes, et les personnes qui utilisent ces biomarqueurs sans regarder attentivement les appellent sénescentes. Vous pourriez dire que cela n’a pas d’importance parce que tout le concept n’a pas beaucoup changé ; qui se soucie du nom que vous donnez à ces cellules ? Si certaines cellules avec certaines propriétés s’accumulent avec la vie et si elles sécrètent quelque chose de mauvais, le concept est toujours intact, et je suis d’accord avec cela.
Cependant, connaissant la nature de ces cellules, nous pouvons choisir la bonne arme contre elles, et tant que nous essayons de tuer les cellules que nous pouvons rendre sénescentes en culture et penser que nous tuons les mêmes cellules in vivo, je pense que nous sommes sur la mauvaise voie. C’est mon premier problème ; mon deuxième problème est que l’accumulation de cellules sénescentes signifie un mauvais fonctionnement du système immunitaire parce que le système immunitaire normal s’en débarrasse très efficacement. Si vous tuez une cellule qui ne peut pas être éliminée par le système immunitaire, vous ne vous débarrassez pas de ces déchets potentiels ; vous les transformez en un autre type de déchets. Parce que pour éradiquer une cellule sénescente, quelque chose a besoin de la trouver et de la manger, de l’avaler, comme un macrophage.
Si cette fonction ne fonctionne pas très bien et que vous aidez simplement le système immunitaire en tuant ces cellules, elles restent à l’endroit où elles se trouvaient ; elles sont simplement mortes. Peut-être que c’est bon ou pas ; peut-être que cela aidera en effet une autre branche du système immunitaire à se nettoyer. Je pense, en général, que ce n’est pas évident ; tout d’abord, il n’est pas évident pour moi que les cellules sénescentes sont uniques en créant l' »odeur » de déchets qui mène à l’inflammation ou si c’est seulement l’un des nombreux types de cellules qui s’endommagent et s’accumulent avec l’âge. Je ne suis pas sûr que le fait de les tuer physiquement aide vraiment à améliorer la situation, car vous créez une vague de restes dont il faut aussi prendre soin.
Personnellement, j’ai choisi une approche pour investir dans le système immunitaire et réparer sa fonction afin qu’il puisse mieux faire son travail, au lieu de penser que nous pouvons le remplacer. Jusqu’à présent, en médecine, la substitution de la fonction perdue n’a bien fonctionné qu’en orthopédie, mais pas dans d’autres domaines. Par conséquent, je pense que nous devons soit investir dans un mécanisme qui bloque l’apparition des cellules sénescentes, soit investir dans le mécanisme d’éradication naturelle pour améliorer le fonctionnement du système immunitaire. Par exemple, si la partie du système immunitaire qui est responsable de l’élimination des cellules sénescentes est épuisée, vous pouvez toujours essayer de rediriger l’immunité adaptative contre elles par la vaccination ; je verrais cela comme une chose plus attrayante.




















 La protéomique, c’est avant tout une approche multiple, prenant en compte les interactions avec d’autres disciplines, notamment la génomique, et faisant appel à des concepts intercroisés avec l’immunologie, la fonction cellulaire ou la nutrition.
La protéomique, c’est avant tout une approche multiple, prenant en compte les interactions avec d’autres disciplines, notamment la génomique, et faisant appel à des concepts intercroisés avec l’immunologie, la fonction cellulaire ou la nutrition. « Last but not least » comme diraient nos amis anglophones. La métobolomique, c’est la compréhension de réseaux de régulation complexes et la découverte quotidienne de nouveaux acteurs dans les communications entre nos cellules.
« Last but not least » comme diraient nos amis anglophones. La métobolomique, c’est la compréhension de réseaux de régulation complexes et la découverte quotidienne de nouveaux acteurs dans les communications entre nos cellules.