[Vidéo] Les 9 causes du vieillissement, épisode 5, Mitochondries – avec le Dr Guilhem Velvé Casquillas
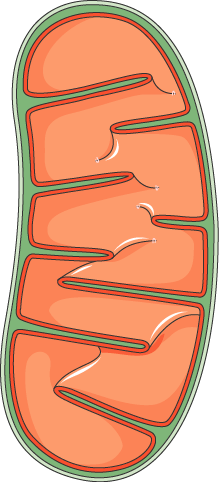
Mitochondries : définition
Nous allons aborder ici une cinquième cause identifiée du vieillissement : le dysfonctionnement des mitochondries.
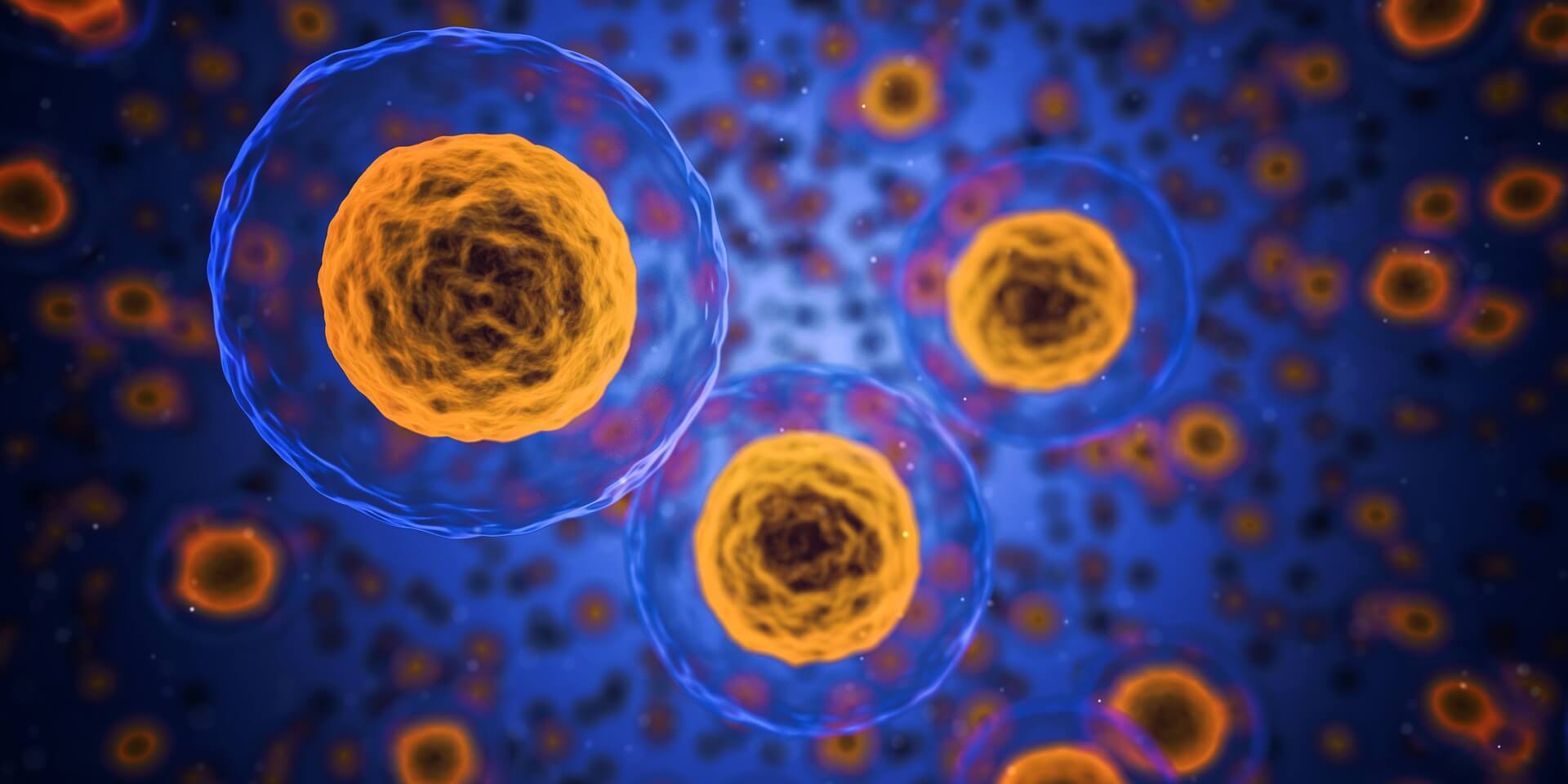
Les mitochondries sont des organites présents dans chacune de vos cellules. Leur rôle est de maintenir la respiration cellulaire et la création d’ATP (adénosine triphosphate), qui est la principale source d’énergie indispensable pour tous les mécanismes du corps humain. En somme, les mitochondries sont les centrales énergétiques de vos cellules.

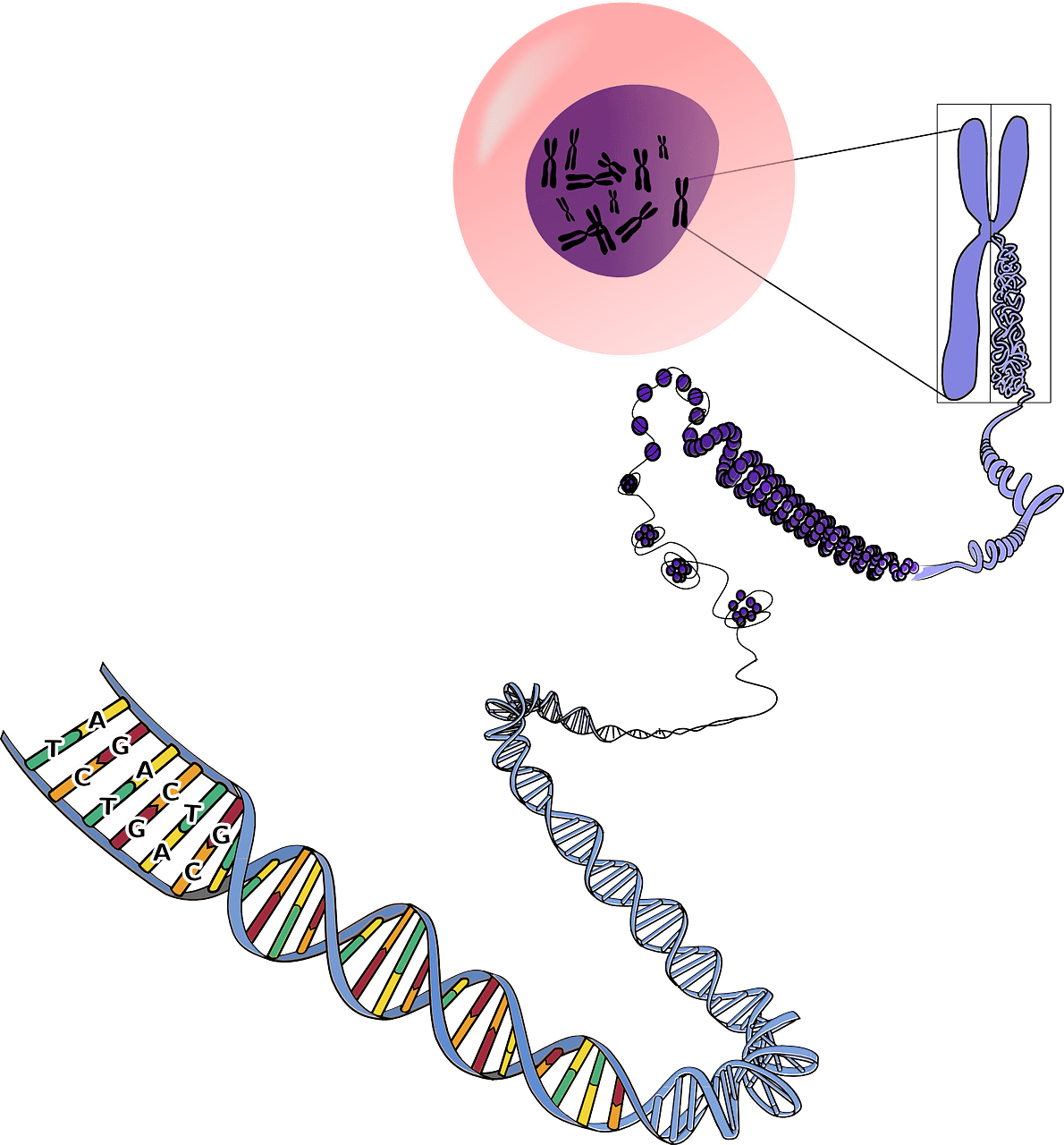
À noter que, en dehors du noyau, les mitochondries sont les seuls organites de vos cellules à posséder leur propre ADN, on appelle celui-ci l’ADN mitochondrial. Donc dans chacune de vos cellules, vous avez non seulement l’ADN du noyau, transmis par vos deux parents, mais aussi l’ADN de vos mitochondries, transmis par votre mère biologique. Cependant, les protéines présentes à l’intérieur de vos mitochondries et qui permettent leur fonctionnement ne sont pas toutes issues de l’ADN mitochondrial.
Pour mieux comprendre pourquoi les mitochondries dysfonctionnement, des études ont été faites sur l’évolution du fonctionnement des mitochondries à différents stades de la vie. Ces études ont montré que le dysfonctionnement des mitochondries était non seulement un marqueur du vieillissement, mais survenait sans qu’on observe de modification significative sur l’ADN mitochondrial. Cela suggère qu’une mutation de l’ADN mitochondrial n’est pas la seule cause du dysfonctionnement lié à l’âge de la mitochondrie, et que celui-ci serait dû à un ou plusieurs autres phénomènes.
Mitochondries et radicaux libres
Alors, quels sont nos suspects ?
En premier lieu, le stress oxydatif. C’est un mécanisme qui implique entre autres des molécules qu’on appelle radicaux libres. Ces radicaux libres possèdent, comme leur nom l’indique, des atomes libres de fixer d’autres molécules par oxydation et ainsi de créer des dommages à vos cellules. On a longtemps lié le vieillissement à l’usure engendrée par l’oxydation, mais la réalité est peut-être plus complexe. Des études récentes ont en effet montré qu’augmenter ses niveaux d’antioxydants, qui combattent les radicaux libres, n’avait pas d’effet sur l’espérance de vie, alors qu’en augmentant le niveau de radicaux libres dans certains modèles, on pouvait augmenter la durée de vie.


Une explication possible : ce stress oxydatif forcerait l’activation des mécanismes de régénérescence potentiellement bénéfiques, comme l’autophagie, que nous avons évoquée précédemment. On le rappelle, l’autophagie est avant tout un moyen de défense de vos cellules : lorsqu’un organite ne fonctionne plus bien, la cellule va le cannibaliser pour permettre sa survie. L’autophagie des mitochondries endommagées, appelée aussi mitophagie, est la principale voie d’élimination de ces mitochondries. Les radicaux libres libérés par le stress oxydant pourraient engendrer un signal de survie bénéfique.
En théorie, on suppose aujourd’hui que lors du vieillissement, le stress cellulaire et le nombre de lésions des cellules augmenteraient. Les niveaux de radicaux libres dans le corps augmenteraient parallèlement, dans le but de préserver l’organisme. Au-delà d’un certain point, ces niveaux cesseraient de maintenir l’équilibre cellulaire et pourraient aggraver les problèmes associés à l’âge.
Le rôle des radicaux libres n’est donc pas encore clair pour les scientifiques, c’est une question qui fait vraiment débat.

Mitochondries : communication intercellulaire
La deuxième cause qui lierait les mitochondries au vieillissement pourrait être la communication entre le noyau de la cellule et ses mitochondries.
Cette communication est nécessaire pour la réplication de la mitochondrie, elle est donc essentielle pour la cellule. Avec le vieillissement, les communications entre le noyau et les mitochondries se dégradent. Cette mauvaise communication peut mener à la détérioration des mitochondries, un phénomène qui à son tour entraîne un vieillissement de la cellule par diminution de l’énergie disponible.
Mitochondries : mutations de l’ADN mitochondrial
Et pour finir, il n’est cependant pas exclu que les mutations de notre ADN mitochondrial entrent aussi en compte. On va donc en parler un peu, même si elles ne sont pas forcément prédominantes.
L’implication des mutations de l’ADN mitochondrial dans le processus de vieillissement a été prouvée : il a été montré qu’une détérioration de l’ADN mitochondrial pouvait engendrer un vieillissement prématuré et réduire la durée de vie.
Bien que l’impact de ces mutations ne soit pas aussi délétère que des mutations de l’ADN nucléaire, les scientifiques pensent qu’il est probable que l’ADN mitochondrial soit plus sensible aux mutations. En effet, une mitochondrie, sorte de centrale énergétique de vos cellules, n’est pas une zone confortable pour éviter des mutations génétiques. D’autant que les mécanismes de réparation de l’ADN mitochondrial sont bien moins évolués que ceux de l’ADN nucléaire.
Cependant, rassurez-vous, contrairement à l’ADN nucléaire, il y a dans chacune de vos cellules plusieurs centaines de mitochondries. Or, les nombreuses copies d’ADN mitochondrial dans chacune de vos cellules atténuent probablement les conséquences d’une lésion sur ce type d’ADN. Malgré cela, il a été prouvé que le nombre de mitochondries diminuait avec l’âge dans les cellules hépatiques des souris, des rats et des humains, et donc, la quantité d’ADN mitochondrial diminuerait au cours du temps.
En résumé, l’accumulation des mutations au cœur du génome mitochondrial pourrait progressivement prendre une place de plus en plus importante dans les processus de vieillissement.
Dr Guilhem Velvé Casquillas

Author/Reviewer
Auteur/Relecteur
Physics PhD, CEO NBIC Valley, CEO Long Long Life, CEO Elvesys Microfluidic Innovation Center
More about the Long Long Life team
Docteur en physique, CEO NBIC Valley, CEO Long Long Life, CEO Elvesys Microfluidic Innovation Center
En savoir plus sur l’équipe de Long Long Life




![Vidéo – Les 9 causes du vieillissement, épisode 9, Inflammation [FINAL] – avec le Dr Guilhem Velvé Casquillas](http://www.longlonglife.org/wp-content/uploads/2019/05/Inflammation-Long-Long-Life-longévité-vieillissement-transhumisme-inflammaging-1-218x150.png)







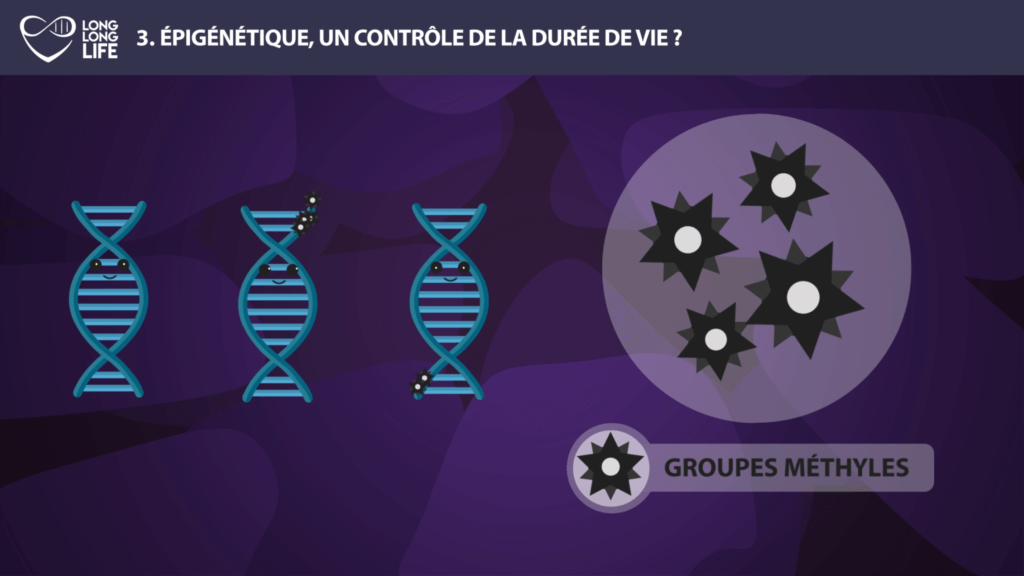



 Avec la naissance de l’épigénétique, une nouvelle technologie a vu le jour : l’epigenome editing, grâce à des avancées telles que l’outil CRISPR-Cas9.
Avec la naissance de l’épigénétique, une nouvelle technologie a vu le jour : l’epigenome editing, grâce à des avancées telles que l’outil CRISPR-Cas9. 
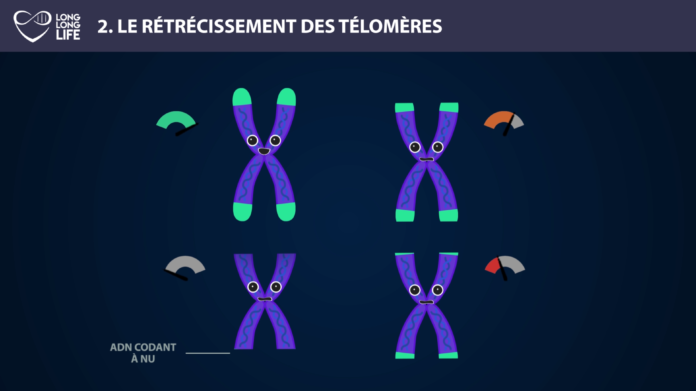
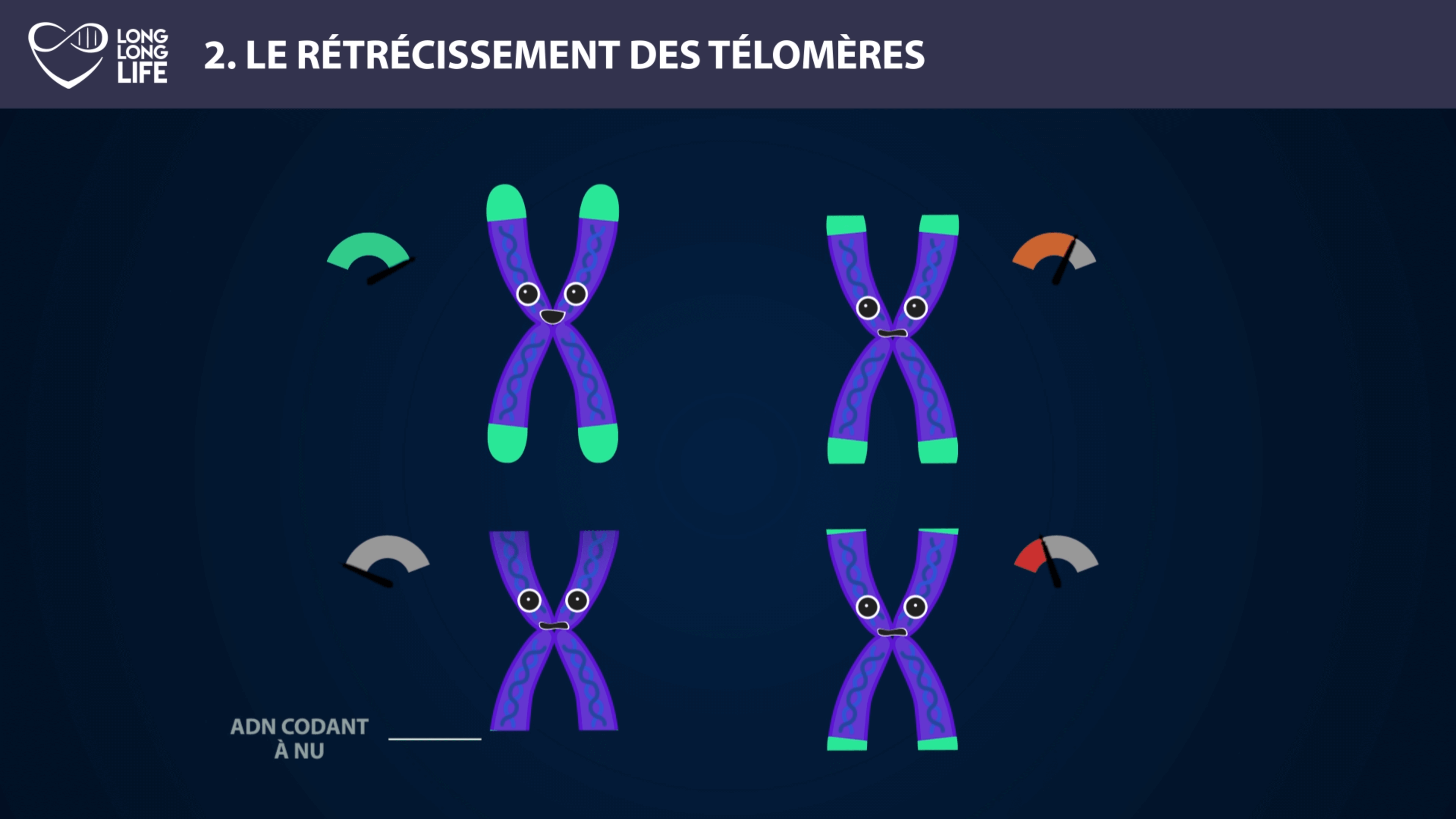
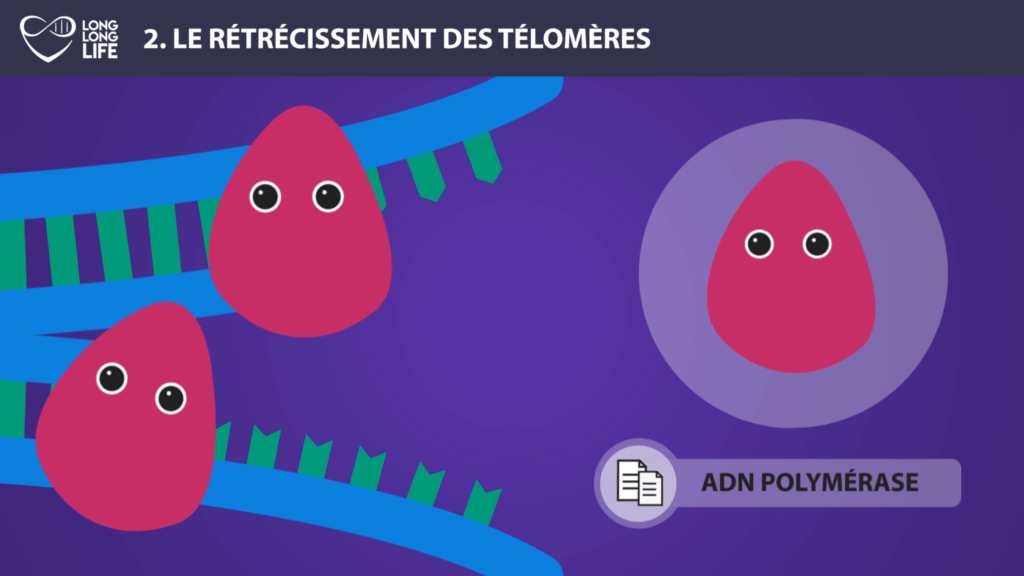





 La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !
La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !