Fight Aging! Extraits
Parce que tout le monde ne comprend pas forcément la langue de Shakespeare, Long Long Life vous fournit une traduction automatique post-éditée des éléments les plus importants de la newsletter Fight Aging!
Fight Aging! fournit un résumé hebdomadaire des actualités et des commentaires pour des milliers d’abonnés intéressés par la science de la longévité: progrès en matière de contrôle médical du vieillissement afin de prévenir la vulnérabilité, la souffrance et les maladies liées à l’âge, ainsi que pour fournir des améliorations dans la compréhension actuelle de ce qui fonctionne et ce qui ne fonctionne pas lorsqu’il s’agit de prolonger une vie saine. Attendez-vous à voir des résumés des récents progrès de la recherche médicale, des nouvelles de la communauté scientifique, des initiatives de collecte de fonds pour accélérer le travail sur la réparation et l’inversion du vieillissement, des liens vers des ressources en ligne, et bien plus encore.
Ce contenu est publié sous la licence Creative Commons Paternité 4.0 International License. Nous vous encourageons à le republier et à le réécrire comme bon vous semble, la seule condition étant de fournir une attribution et un lien vers Fight Aging!
Pour vous abonner ou vous désabonner, veuillez visiter le site de Fight Aging!: https://www.fightaging.org/newsletter/
Extraits de Fight Aging! :
- Une longue réflexion sur le stress oxydatif dans l’évolution de la maladie d’Alzheimer
- Résultats d’un autre essai de fabrication de tissu de pigment rétinien
- Incertitude quant à l’existence ou non d’une neurogenèse chez l’adulte à un degré significatif
- Les espèces à longue durée de vie peuvent nécessiter une plus grande précision dans la traduction des protéines
- Un marqueur pour les cellules souches cancéreuses qui pourrait aussi mener à un traitement qui tue les cellules
Une longue réflexion sur le stress oxydatif dans l’évolution de la maladie d’Alzheimer
La maladie d’Alzheimer est très complexe et incomplètement comprise parce que le cerveau est très complexe et incomplètement compris. Les efforts visant à faire progresser les traitements de la maladie d’Alzheimer ont progressé parallèlement aux efforts, souvent motivés et financés, visant à cartographier les travaux du cerveau au niveau de détail de la biochimie cellulaire. Même si la maladie d’Alzheimer aura des causes faciles à énoncer, un ensemble de processus biochimiques relativement simples, même des origines simples s’étendent – au fil du temps et à travers des chaînes de causes et d’effets – pour produire des états finaux aussi complexes que leur environnement.
Les chercheurs ont tendance à se spécialiser. Il y a trop de biochimie pour tout garder dans un seul esprit, même pour une seule condition médicale. Ainsi, le milieu de la recherche a tendance à agir dans la pratique comme les aveugles et l’éléphant, chacun se concentrant sur sa facette particulière de la plus grande condition. Il est nécessaire de se concentrer pour progresser dans la compréhension de cette facette, mais à la fin de la journée, quelqu’un doit à l’occasion revoir toutes les facettes en même temps pour voir si l’image a encore du sens. La synthèse est une fonction de plus en plus importante dans la recherche moderne en sciences de la vie, qui devient de plus en plus difficile à mesure que la taille des facettes augmente, mais malheureusement, elle demeure sous-évaluée. La recherche et le développement de la maladie d’Alzheimer attendent toujours une synthèse définitive, la théorie et les preuves qui nous montreront lesquelles des facettes de la maladie sont importantes, lesquelles sont primaires et lesquelles sont secondaires.
Le présent document en libre accès traite du point de vue du stress oxydatif de la maladie d’Alzheimer, une base pour considérer la progression de la maladie qui ne reçoit pas autant d’attention que les travaux sur les agrégats de l’amyloïde-β et de la tau. Le stress oxydatif fait référence au niveau croissant des molécules oxydatives et aux signes des dommages qu’elles causent aux machines moléculaires à l’intérieur et à l’extérieur des cellules. L’oxydation est un fait de la vie dans les cellules, une partie nécessaire du fonctionnement de la biologie : les dommages se produisent constamment, et sont réparés constamment. De plus en plus de dommages oxydatifs et de molécules oxydatives sont présents dans le corps et le cerveau avec la progression du vieillissement, parallèlement à une croissance de l’inflammation chronique – le stress oxydatif et l’inflammation sont généralement trouvés ensemble, liés par un certain nombre de mécanismes. La maladie d’Alzheimer et la plupart des autres affections neurodégénératives semblent avoir une forte composante inflammatoire, et il y a donc aussi un stress oxydatif à surveiller.
Un long voyage dans le vieillissement, le vieillissement cérébral et la maladie d’Alzheimer sur les traces du stress oxydatif.
De nos jours, la maladie d’Alzheimer (MA) est le type de démence le plus diagnostiqué. Pendant longtemps, les plaques amyloïde-β (Aβ) et les enchevêtrements neurofibrillaires (NFT) ont été considérés sans conteste comme la cause principale de la pathogenèse de la MA, mais de nombreuses autres théories ont été proposées, y compris le stress oxydatif et la neuroinflammation, pour expliquer une maladie encore inconnue.
Pendant de nombreuses années, l’hypothèse de la cascade amyloïde a dominé la pensée, la modélisation et l’approche thérapeutique de la MA. Les protéines amyloïdes sont des protéines bêta qui peuvent facilement s’agréger. Aβ est un produit de dégradation protéolytique d’une molécule plus grosse appelée précurseur de protéine amyloïde-β (AβPP). L’hypothèse de la cascade amyloïde postule une surproduction de Aβ, ce qui conduit à un dysfonctionnement neuronal et à l’apoptose causant des manifestations cliniques de la MA. Selon cette hypothèse, l’accumulation amyloïde représente l’événement « en amont » de la pathogenèse de la maladie d’Alzheimer. Ce point de vue a été surmonté par la possibilité que les oligomères solubles Aβ, plus que les plaques amyloïdes matures, sont les principaux fragments toxiques. En fait, il a été démontré que les oligomères amyloïdes peuvent accéder aux organelles intracellulaires, y compris les mitochondries, et compromettre leur fonction. Le dépôt amyloïde provoque des altérations inflammatoires et immunologiques locales pour une neurotoxicité directe avec recrutement microglial et activation des astrocytes. Elle est également associée à la libération de cytokines, d’oxyde nitrique et d’autres espèces radicales qui peuvent favoriser la neuroinflammation et la neurodégénérescence.
En plus de la cascade amyloïde, on trouve des enchevêtrements neurofibrillaires intracellulaires (NFT) dans le cerveau atteint de la maladie d’Alzheimer. Ils sont constitués d’une protéine tau hyperphosphorylée. Il est intéressant de noter que les TNI sont en corrélation plus étroite avec la gravité de la démence que le nombre de plaques. L’association des enchevêtrements avec une variété de lésions cérébrales soutient le concept de « tauopathie » de la neurodégénérescence, bien que la tauopathie en tant que cause principale de maladies neurodégénératives ne puisse actuellement être démontrée que dans un sous-groupe de démence frontotemporale familiale. Cependant, les récents échecs des médicaments ciblant les voies amyloïdes ont soulevé des questions non seulement sur cette approche, mais aussi sur la validité de l’hypothèse de la cascade amyloïde elle-même.
Le stress oxydatif est une situation où la production d’espèces réactives de l’oxygène (ROS) dépasse le système de défense antioxydant cellulaire. Le cerveau est très sensible à un déséquilibre oxydatif en raison de sa demande énergétique élevée, de sa consommation élevée d’oxygène, de l’abondance d’acides gras polyinsaturés facilement peroxydables, d’un niveau élevé de fer catalytique ROS puissant et d’une relative pénurie d’enzymes antioxydantes, cette dernière étant plus évidente dans le cerveau AD. Les mitochondries sont sujettes aux dommages oxydatifs. L’ADN mitochondrial (ADNmt) est particulièrement sensible aux dommages oxydatifs. L’augmentation simultanée de l’oxydation de l’ADNmt et la déficience de la réparation de l’ADN pourraient améliorer la lésion du génome mitochondrial, ce qui pourrait causer des dommages neuronaux. Sur cette base, il est raisonnable de penser que les dommages causés aux biomolécules par oxydation sont largement rapportés dans la maladie d’Alzheimer, ce qui suggère que le stress oxydatif joue un rôle critique dans la pathogenèse de la maladie. En tant que principale source de production de ROS et cible majeure des dommages oxydatifs, l’altération progressive des mitochondries a été impliquée dans le vieillissement et la MA.
Il est généralement admis que la fonction mitochondriale diminue progressivement avec l’âge lorsque la compensation n’est plus possible. En résumé, l’hypothèse de la cascade mitochondriale propose que chaque personne possède une ligne de départ mitochondriale génétiquement déterminée, qui, avec les facteurs environnementaux, détermine l’âge auquel une maladie clinique peut survenir. Ainsi, l’hypothèse de la « cascade mitochondriale » place le dysfonctionnement mitochondrial comme le principal facteur de la cascade de pathologie de la maladie d’Alzheimer tardive, qui sous-tend l’arrière-plan génétique individuel capable de réguler depuis la naissance sa fonction mitochondriale et sa durabilité. Pour cette raison, le taux auquel la dysfonction mitochondriale liée à l’âge évolue diffère d’une personne à l’autre. Lorsque la fonction mitochondriale diminue et tombe en dessous d’un seuil critique, un dysfonctionnement typique de la maladie d’Alzheimer au niveau cellulaire peut survenir, y compris la production de Aβ, la phosphorylation tau, la dégénérescence synaptique et le stress oxydatif.
Résultats d’un autre essai de fabrication de tissu de pigment rétinien
Il y a quelques semaines à peine, j’ai noté les résultats d’un essai précoce d’une forme de pansement rétinien, dans lequel les patients concernés montraient des signes frappants d’amélioration de la vision, compte tenu de leur âge et du degré d’avancement de leur dégénérescence maculaire. Aujourd’hui, un autre ensemble de résultats d’essais cliniques a été publié par un groupe distinct utilisant une approche similaire – les cellules souches embryonnaires humaines sont utilisées pour obtenir suffisamment de cellules épithélium pigmentaires rétiniennes pour créer une zone structurée, ressemblant au moins à des tissus rétiniens à certains égards. Le pansement est ensuite implanté dans la rétine, et suffisamment de cellules survivent et s’intègrent pour restaurer certaines fonctions dans les zones endommagées par la progression de la dégénérescence maculaire liée à l’âge. Le fait que deux équipes voient des résultats positifs de ce type d’approche est une bonne nouvelle pour l’ensemble du domaine.
L’avancée par rapport aux efforts antérieurs pour produire une thérapie cellulaire pour la dégénérescence maculaire, présente dans ces deux essais, réside dans les méthodologies qui permettent aux cellules de former une structure rétinienne plus vivante avant l’implantation. Les cellules transplantées dans la rétine sans ce soutien meurent en grande partie avant qu’elles ne puissent faire beaucoup de bien, et c’est un problème dans tout le spectre des thérapies cellulaires. De nombreuses thérapies cellulaires actuelles ne sont que marginalement bénéfiques, précisément parce que les cellules transplantées durent quelques jours ou quelques semaines au maximum. Ils modifient l’équilibre de la signalisation locale pendant un certain temps, ce qui peut avoir des effets très utiles, comme la suppression de l’inflammation obtenue par les thérapies à base de cellules souches mésenchymateuses, mais cela ne réalise pas le potentiel des thérapies cellulaires pour parvenir à la régénération et au remplacement des tissus.
Au cours des dernières années, la communauté du génie tissulaire a fait des progrès significatifs vers l’administration de patchs structurés plutôt que de cellules seules. Par exemple, les correctifs du muscle cardiaque ont récemment démontré des taux de survie et d’intégration cellulaire beaucoup plus élevés. Tout comme les correctifs rétiniens mentionnés ici, ce sont des cellules et des échafaudages qui sont semblables aux tissus natifs, plus résilients et plus efficaces. Nous devrions nous attendre à ce que ce type d’approche se répande largement dans tout le champ, maintenant qu’il s’est avéré efficace dans de multiples tissus différents – bien que cela prendra un certain temps, car chaque type de tissu nécessite l’établissement de ses propres recettes et méthodes.
Des chercheurs testent un implant rétinien à base de cellules souches pour déterminer la cause commune de la perte de vision.
Le traitement, qui consiste en une couche de cellules souches embryonnaires humaines dérivées de cellules souches d’épithélium pigmentaire rétinien sur une structure de soutien ultra-mince, a été implanté dans la rétine de quatre patients. Les patients ont fait l’objet d’un suivi d’une durée pouvant aller jusqu’à un an pour en évaluer l’innocuité. Il n’y a pas eu d’effets indésirables graves liés à l’implant ou à la procédure chirurgicale, ce qui indique que le traitement était bien toléré. Il a également été prouvé que l’implant s’intégrait avec le tissu rétinien du patient, ce qui est essentiel pour que le traitement puisse améliorer la fonction visuelle.
« Il s’agit du premier essai humain de cet implant novateur à base de cellules souches, conçu pour remplacer une couche unicellulaire qui dégénère chez les patients atteints de dégénérescence maculaire liée à l’âge. Cet implant a le potentiel d’arrêter la progression de la maladie ou même d’améliorer la vision du patient. « Prouver sa sécurité chez l’homme est la première étape pour atteindre cet objectif. » La dégénérescence maculaire liée à l’âge (DMLA) sèche est le type le plus courant de DMLA. Avec le temps, elle peut entraîner une perte de la vision centrale, ce qui peut diminuer la capacité des gens à effectuer des tâches quotidiennes comme la lecture, l’écriture, la conduite automobile et la vision des visages.
Dans le cadre de l’étude, l’équipe de recherche a également effectué une évaluation préliminaire de l’efficacité de la thérapie. Un patient présentait une amélioration de l’acuité visuelle, mesurée par le nombre de lettres qu’il pouvait lire sur un tableau oculaire, et deux patients présentaient une amélioration de la fonction visuelle, mesurée par l’utilisation de la zone de la rétine traitée par l’implant. Aucun des patients n’a présenté de signes de progression de la perte de vision.
Une monocouche épithéliale de pigments rétiniens spécialement conçue pour la dégénérescence maculaire sèche liée à l’âge.
Le dysfonctionnement et la perte de l’épithélium pigmentaire rétinien (EPR) sont une caractéristique de la dégénérescence maculaire non néovasculaire liée à l’âge (DMA). Sans l’EPR, la majorité des photorécepteurs sus-jacents finissent par dégénérer, ce qui entraîne une perte de vision grave et progressive. Les études cliniques et histologiques suggèrent que les stratégies de remplacement de l’EPR peuvent retarder la progression de la maladie ou restaurer la vision. Une étude prospective de phase 1/2a, approuvée par la Food and Drug Administration des États-Unis, est en cours pour évaluer l’innocuité et l’efficacité d’un implant sous-rétinien composite chez des sujets présentant un NNAMD avancé. L’implant composite, appelé California Project to Cure Blindness-Retinal Pigment Epithelium 1 (CPCB-RPE1), consiste en une monocouche polarisée d’EPR dérivé de cellules souches embryonnaires humaines (hESC-RPE) sur un substrat de parylène synthétique ultrafin conçu pour imiter la membrane de Bruch.
Nous présentons une analyse provisoire de la cohorte de la phase 1 composée de cinq sujets. Quatre des cinq sujets inscrits à l’étude ont reçu avec succès l’implant composite. Chez tous les sujets implantés, l’imagerie par tomographie à cohérence optique a montré des changements compatibles avec l’intégration des hESC-RPE et des photorécepteurs hôtes. Aucun des yeux implantés n’a montré une progression de la perte de vision, un œil s’est amélioré de 17 lettres et deux yeux ont montré une meilleure fixation. Les résultats structurels et fonctionnels concomitants suggèrent que le CPCB-RPE1 peut améliorer la fonction visuelle, au moins à court terme, chez certains patients présentant une perte de vision sévère à la suite d’un NNAMD avancé.

Incertitude quant à l’existence ou non d’une neurogenèse chez l’adulte à un degré significatif
Le cerveau humain adulte produit-il normalement un nombre significatif de nouveaux neurones, en les intégrant dans de nouveaux réseaux ? Ce procédé s’appelle la neurogenèse, et jusque dans les années 1990, il était établi que non. Ensuite, des études chez les rongeurs ont révélé que les animaux de ces espèces produisent de nouveaux neurones à un rythme appréciable, et que cela était important pour la mémoire, l’apprentissage, le degré de guérison des dommages tels que les accidents vasculaires cérébraux, ainsi que le vieillissement et la neurodégénérescence, à mesure que le rythme de la neurogenèse diminue avec l’âge. Des études chez les humains ont suivi pour fournir des preuves à l’appui qui semblaient suffisamment convaincantes pour croire que les rongeurs étaient un bon modèle pour d’autres espèces de mammifères, y compris la nôtre. Puis, tout récemment, une étude bien menée chez l’homme n’a trouvé aucune preuve d’un niveau significatif de neurogenèse dans le cerveau humain adulte. Étant donné le degré d’enthousiasme de la communauté scientifique dans la recherche de moyens d’améliorer la régénération du système nerveux central, cela a produit le niveau de débat attendu.
Pour aujourd’hui, et comme illustration supplémentaire de ce à quoi ressemble un domaine en évolution, je vais signaler une autre nouvelle étude dans laquelle les chercheurs se sentent assez confiants pour affirmer que la neurogenèse adulte se produit et se poursuit à des niveaux similaires chez les humains âgés et les jeunes. La science n’est jamais une question de confiance absolue dans un savoir ; en tant que profane, il faut peser les études et les discussions des experts, pour et contre. Ici, cependant, la situation est désordonnée et incertaine : il ne s’est pas écoulé assez de temps pour que le milieu de la recherche puisse traiter correctement les nouvelles découvertes. Attendez-vous à ce qu’il faille quelques années pour parvenir à un nouveau consensus ; il faut au moins un an pour mener à bien une enquête suffisamment lourde, et une autre année pour réussir le défi de l’examen par les pairs et être publié.
Le poids écrasant de la preuve demeure en faveur de la neurogenèse adulte chez les rongeurs, alors que chez les humains, les résultats et les méthodologies sont dans un état d’incertitude soudain. Pourtant, beaucoup de travail a été fait ces dernières années sur la base de l’existence supposée de la neurogenèse adulte, et divers phénomènes neurologiques communs à l’homme et aux rongeurs ont été liés par des théories qui mettent en évidence la neurogenèse adulte. Il ne s’agit donc pas seulement d’une bataille de quelques études du cerveau au niveau cellulaire, mais plutôt de la validité d’un vaste segment de l’effort scientifique au cours des dernières décennies. Sans parler des espoirs d’une voie plus facile à l’avenir vers des moyens d’induire une régénération fonctionnelle dans le cerveau vieillissant.
Les adultes plus âgés développent autant de nouvelles cellules cérébrales que les jeunes.
Les chercheurs montrent pour la première fois que les hommes et les femmes âgés en bonne santé peuvent produire autant de nouvelles cellules cérébrales que les jeunes. Il y a eu une controverse sur la question de savoir si les humains adultes produisent de nouveaux neurones, et certaines recherches ont déjà suggéré que le cerveau adulte était rigide et que les adultes ne produisaient pas de nouveaux neurones. Cette étude va à l’encontre de cette notion, et les résultats peuvent suggérer que de nombreuses personnes âgées demeurent plus intactes sur le plan cognitif et émotionnel que ce que l’on croit généralement.
« Nous avons découvert que les personnes âgées ont la même capacité à fabriquer des milliers de nouveaux neurones hippocampiques à partir de cellules progénitrices que les plus jeunes. Nous avons également trouvé des volumes équivalents de l’hippocampe (une structure du cerveau utilisée pour les émotions et la cognition) à travers les âges. Néanmoins, les personnes âgées avaient moins de vascularisation et peut-être moins de capacité des nouveaux neurones à établir des connexions. Il est possible que la neurogenèse hippocampique continue soutienne les fonctions cognitives propres à l’être humain tout au long de la vie et que le déclin puisse être lié à une résilience cognitive-émotionnelle compromise.
La neurogenèse de l’hippocampe humain persiste tout au long du vieillissement.
Le vieillissement en santé est crucial dans une population vieillissante. La capacité de séparer des schémas de mémoire similaires et de récupérer du stress peut dépendre de la neurogenèse de l’hippocampe adulte (NSA), qui diminue avec le vieillissement chez les primates et les souris non humains. De nouveaux neurones sont générés dans le gyrus denté (DG) de l’hippocampe humain adulte, même après l’âge moyen, mais la mesure dans laquelle la neurogenèse se produit chez l’homme est très controversée et les études quantitatives sont rares.
Les différences phylogénétiques entre les humains et les rongeurs nécessitent l’évaluation des différents stades de maturation neuronale dans la DG humaine. Par exemple, la neurogenèse striatale n’est présente que chez l’homme, tandis que la neurogenèse olfactive est absente chez l’homme mais présente chez d’autres mammifères. Les analyses antérieures de la NHI humaine n’ont pas abordé les effets du vieillissement, bien que des études aient examiné la NHI dans des populations plus âgées. À l’aide de techniques histologiques qui ne permettaient pas de distinguer les neurones matures et immatures, plusieurs groupes ont estimé que les neurones de la DG ne diminuaient pas chez les humains vieillissants.
L’AHN et l’angiogenèse sont corégulées. L’exercice augmente le volume sanguin cérébral, ce qui se traduit par une plus grande quantité d’AHN chez la souris et une meilleure performance cognitive chez l’homme, mais il peut avoir un impact réduit chez les personnes âgées. Ainsi, nous avons quantifié l’AHN, l’angiogenèse et le volume de la DG et leur relation chez des personnes d’âges différents, en émettant l’hypothèse qu’ils diminueraient simultanément avec le vieillissement et seraient corrélés les uns avec les autres. Compte tenu des différentes fonctions de la DG rostrale et caudale, nous avons évalué l’hippocampe antérieur, moyen et postérieur post-mortem de 28 femmes et hommes âgés de 14 à 79 ans. Dans chaque région, nous avons caractérisé et quantifié l’angiogenèse, le volume et les cellules à différents stades de maturation dans la niche neurogène de la DG, en utilisant des méthodes stéréologiques non biaisées. Pour éviter les facteurs de confusion, les sujets étudiés n’avaient pas de maladie neuropsychiatrique ou de traitement.
Chez les sujets sans médication, sans maladie cérébrale et sans déficience cognitive signalée, bon fonctionnement global selon l’échelle d’évaluation globale, et faible stress lié aux événements de la vie récente (3 derniers mois), quantifié par l’échelle d’expérience de vie St. Paul-Ramsey, nous avons trouvé une NSA persistante dans la huitième décennie de la vie, et un volume stable de production de drogues injectables sur une période d’âge de 65 ans. En revanche, nous avons constaté une diminution de la neuroplasticité et de l’angiogenèse avec l’âge, ainsi qu’une diminution possible du nombre de cellules progéniteurs neuronaux (QNPs) de type I multipotentes quiescentes de type radial-glia-like (QNPs) sélectivement dans le DG antéro-moyen, tandis que le pool QNP est resté inchangé dans le DG postérieur, reflétant peut-être moins de résilience cognitive et émotionnelle avec le vieillissement.
Les primates non humains plus âgés et les rongeurs ont plus de neurones granulés (GN) et moins d’AHN que les plus jeunes, contrairement à ce que nous avons constaté chez les humains. Puisque les nouveaux GNs peuvent aider à la séparation des modèles et les anciens GNs à compléter les modèles, l’AHN stable et l’élimination simultanée des anciens GNs soutient probablement l’apprentissage complexe et la mémoire humaine et le comportement guidé par les émotions tout au long de la vie. La persistance de l’AHN est vitale pour préserver la flexibilité cognitive et permettre une prise de décision guidée par la mémoire sans l’interférence d’informations non pertinentes et dépassées. Nos découvertes de milliers de nouveaux progéniteurs neuronaux intermédiaires (PNI) et de neurones immatures au moment de la mort, dans la zone sous-granulaire humaine antérieure, médiane et postérieure, suggèrent que le nombre de neurones nouvellement générés pourrait être suffisant pour qu’ils aient un impact pertinent sur le circuit de la DG.
Les espèces à longue durée de vie peuvent nécessiter une plus grande précision dans la traduction des protéines
Ce commentaire sur des résultats de recherche de l’année dernière est une bonne introduction au sujet des erreurs de traduction des protéines et de leur relation avec la longévité des espèces. La traduction est l’une des étapes du processus complexe d’expression génique, dans lequel les gènes servent de modèle pour assembler les protéines. Rien n’est parfait et les erreurs se produisent dans la traduction, comme partout ailleurs. De telles erreurs sont en fait une forme de dommage, causant des problèmes pour la cellule jusqu’à ce que la protéine défectueuse soit éliminée.
Il est assez bien établi que des niveaux plus élevés des processus d’entretien cellulaire de l’autophagie, responsables de l’élimination des protéines endommagées, des déchets métaboliques et des structures cellulaires défaillantes, peuvent ralentir le vieillissement chez diverses espèces. Il semble plausible que la réduction de la vitesse à laquelle les protéines malformées sont produites serait bénéfique pour des raisons similaires, mais c’est plus difficile à prouver d’une manière ou d’une autre. Le laboratoire actuel est composé de la biochimie d’espèces similaires avec des durées de vie, des mécanismes de traduction et des taux d’erreur différents. Malheureusement, il y a aussi beaucoup d’autres différences : l’étude du vieillissement est rendue très difficile par l’incapacité d’isoler complètement les mécanismes d’intérêt et de les composer vers le haut ou vers le bas sans rien changer d’autre.
Lorsqu’une protéine est fabriquée par la cellule, l’information génétique est d’abord décodée en ARNm, puis cet ARNm dirige la synthèse de la protéine. Il s’agit du flux d’informations génétiques dans les cellules, de l’ADN à l’ARN aux protéines, le dogme central de la biologie moléculaire. La théorie du vieillissement de la « catastrophe des erreurs », proposée dans les années 1960, postule que les erreurs de traduction diminuent la fidélité de la traduction, mettant en mouvement un cercle vicieux de synthèse protéique de plus en plus inexacte, causant finalement une défaillance de la machine d’expression génétique. Cependant, dans les années 1980, plusieurs approches, y compris les essais enzymatiques des erreurs de synthèse des protéines, ainsi que l’analyse des protéines sur gels 2D chez les animaux âgés et les cellules sénescentes, n’ont pas détecté une augmentation significative des protéines mal traduites pendant le vieillissement et la sénescence cellulaire. Ces résultats négatifs n’étaient pas conformes à la théorie de la catastrophe de l’erreur et les erreurs de traduction ont été largement écartées comme étant un facteur contribuant au vieillissement.
Des travaux récents ramènent la fidélité de la traduction des protéines à l’avant-scène de la recherche sur le vieillissement. Il est important de noter que les tests utilisés pour détecter les protéines aberrantes dans les années 1980 avaient une sensibilité limitée pour détecter les protéines aberrantes rares, mais en 2013, un nouveau test très sensible à base de luciférase a été mis au point pour mesurer le taux de mauvaise traduction dans les cellules de mammifères. Ce nouveau test a montré que les fibroblastes de souris font jusqu’à 10 fois plus d’erreurs dans la traduction des protéines que les fibroblastes de l’espèce de rongeur qui vit le plus longtemps, le rat taupe nu. C’était la première indication qu’une espèce à plus longue durée de vie peut développer des machines de traduction de protéines plus précises. Des travaux ultérieurs ont comparé la fidélité de la traduction des protéines dans les fibroblastes de 17 espèces de rongeurs de différentes durées de vie, et ont démontré que la fidélité de traduction aux première et deuxième positions du code est en corrélation positive avec la durée de vie maximale des espèces, c’est-à-dire que les espèces à plus longue durée de vie ont une traduction plus précise.
La relation entre la durée de vie maximale des espèces et la fidélité de traduction montre que les espèces à plus longue durée de vie évoluent vers une synthèse protéique plus précise. Cela ne signifie pas pour autant que les erreurs de traduction des protéines conduisent au vieillissement des organismes individuels. Il serait important de tester avec les nouveaux tests sensibles. À l’avenir, il sera possible de créer un modèle murin avec des rapporteurs de luciférase pour examiner l’accumulation de protéines mal traduites dans différents organes au cours du vieillissement. Les protéines mal traduites peuvent ne pas avoir d’impact significatif sur la protéostase cellulaire à un jeune âge, en grande partie en raison d’un renouvellement rapide des protéines et d’une clairance efficace des protéines. Cependant, les taux de renouvellement des protéines, l’activité protéasome et l’autophagie diminuent avec l’âge, ce qui rend les organismes âgés plus sensibles aux erreurs de traduction des protéines. Ainsi, même si la fidélité de la traduction des protéines ne change pas au cours de la vie, les espèces à longue durée de vie peuvent nécessiter une synthèse protéique plus précise.

Un marqueur pour les cellules souches cancéreuses qui pourrait aussi mener à un traitement qui tue les cellules
Au moins certaines formes de cancer sont générées et soutenues par une petite population de cellules souches cancéreuses, miroir de l’environnement tissulaire sain dans lequel un grand nombre de cellules somatiques sont soutenues par un petit nombre de cellules souches. C’est la présence de ces cellules souches cancéreuses qui fait qu’il est difficile d’éliminer définitivement le cancer d’un patient – si seulement quelques cellules de ce type survivent, le cancer réapparaîtra et la génération actuelle de traitements anticancéreux ne peut pas éliminer de façon fiable 100 % des cellules ciblées. D’un autre côté, si une méthode de ciblage et de destruction sélective des cellules souches cancéreuses pouvait être mise au point, il s’agirait d’une approche très utile pour le traitement du cancer. Bien qu’il y ait encore un débat sur le degré de similitude utile et exploitable entre les cellules souches cancéreuses qui ont été identifiées dans différents types de cancers, la recherche ici est intéressante à lire dans ce contexte. Il suggère fortement que ces similitudes existent et sont largement présentes dans de nombreux types de tissus.
« Les » cellules souches cancéreuses « , aussi appelées cellules initiatrices de tumeur (TIC), semblent causer des rechutes après la radiothérapie et la chimiothérapie, car une seule TIC survivante peut provoquer la croissance d’une nouvelle tumeur. De plus, ils semblent être la cause principale des métastases. Un traitement tumoral efficace doit donc viser à tuer les TIC aussi largement que possible. A cette fin, une « sonde » qui marque ces cellules souches cancéreuses serait utile pour qu’elles deviennent visibles. Bien qu’il existe des marqueurs qui reconnaissent également les TIC associées à certains types de cancer, aucune sonde universelle et sélective pour les cellules souches cancéreuses n’a été trouvée.
Les chercheurs ont maintenant réussi à trouver une telle sonde. Ils ont pu montrer que leur nouvelle sonde, un colorant fluorescent, tache sélectivement les TIC d’une grande variété de cancers, y compris les tumeurs du poumon, du système nerveux central, du sein, du rein, de l’ovaire, du côlon et de la prostate, ainsi que les mélanomes. Les cellules saines et les cellules tumorales « ordinaires » n’étaient pas marquées. À des concentrations élevées, le colorant démontre également une cytotoxicité considérable à l’égard des TIC, alors que les autres cellules sont à peine affectées.
Les chercheurs ont découvert que leur sonde, nommée TiY (pour tumor-initiating cell probe yellow), reconnaît la vimentine, qui est une molécule dans le cytosquelette. La vimentine est plus concentrée dans les cellules épithéliales lorsqu’elles se transforment en cellules mésenchymateuses. Les cellules épithéliales forment le tissu qui recouvre les surfaces intérieure et extérieure du corps, formant une frontière avec l’environnement. Les cellules sont polaires, ce qui signifie que le côté tourné vers le tissu sous-jacent et le côté dirigé vers l’extérieur vers la lumière sont différents. Les cellules sont également solidement intégrées dans la paroi cellulaire. Lorsqu’ils se transforment en cellules mésenchymateuses, ils perdent leur polarité, sont libérés de la structure cellulaire et peuvent errer. Ce processus joue un rôle important dans le développement des embryons et la cicatrisation des plaies. Elle est également impliquée dans la métastase des tumeurs.




 Cette méthode de métrologie du vieillissement et de l’âge physiologique procède au bilan de diverses caractéristiques biologiques et physiques qui ont un lien avéré avec les processus de vieillissement (dosage du cholestérol, appui monopodal, obésité abdominale…).
Cette méthode de métrologie du vieillissement et de l’âge physiologique procède au bilan de diverses caractéristiques biologiques et physiques qui ont un lien avéré avec les processus de vieillissement (dosage du cholestérol, appui monopodal, obésité abdominale…).





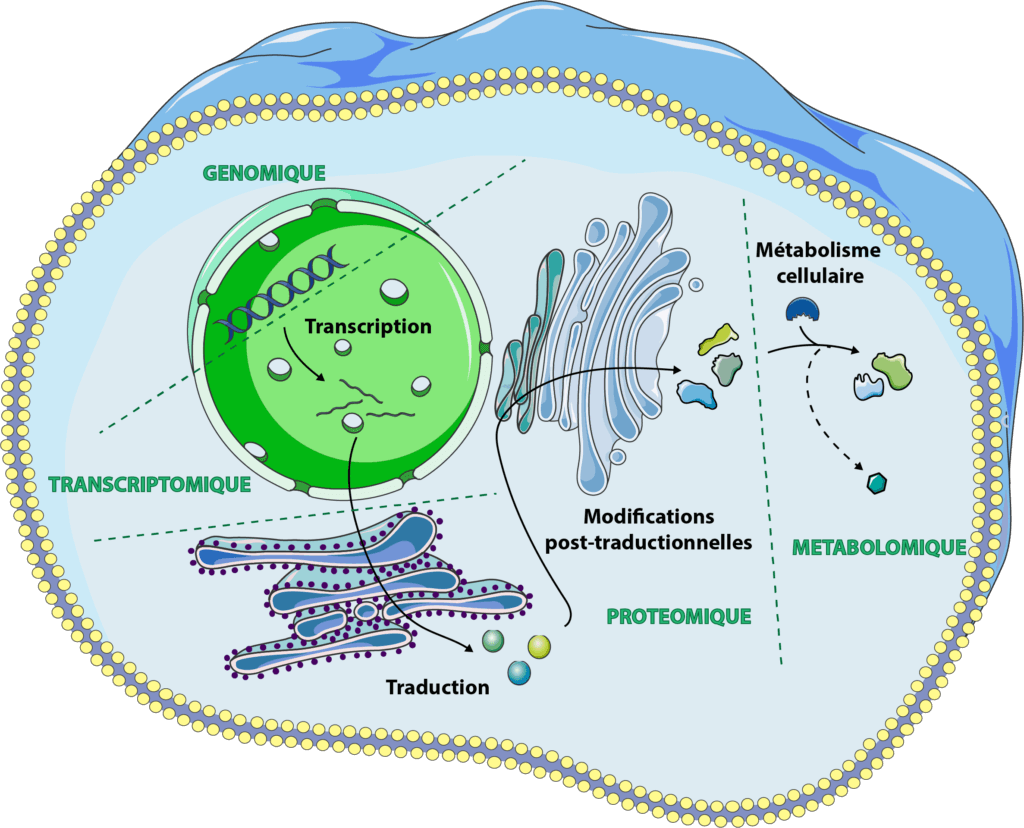


 La protéomique, c’est avant tout une approche multiple, prenant en compte les interactions avec d’autres disciplines, notamment la génomique, et faisant appel à des concepts intercroisés avec l’immunologie, la fonction cellulaire ou la nutrition.
La protéomique, c’est avant tout une approche multiple, prenant en compte les interactions avec d’autres disciplines, notamment la génomique, et faisant appel à des concepts intercroisés avec l’immunologie, la fonction cellulaire ou la nutrition. « Last but not least » comme diraient nos amis anglophones. La métobolomique, c’est la compréhension de réseaux de régulation complexes et la découverte quotidienne de nouveaux acteurs dans les communications entre nos cellules.
« Last but not least » comme diraient nos amis anglophones. La métobolomique, c’est la compréhension de réseaux de régulation complexes et la découverte quotidienne de nouveaux acteurs dans les communications entre nos cellules.






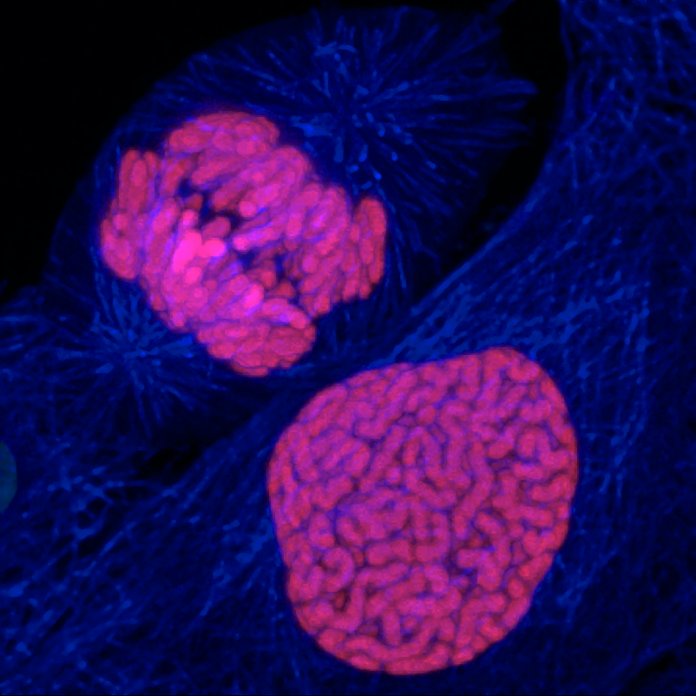
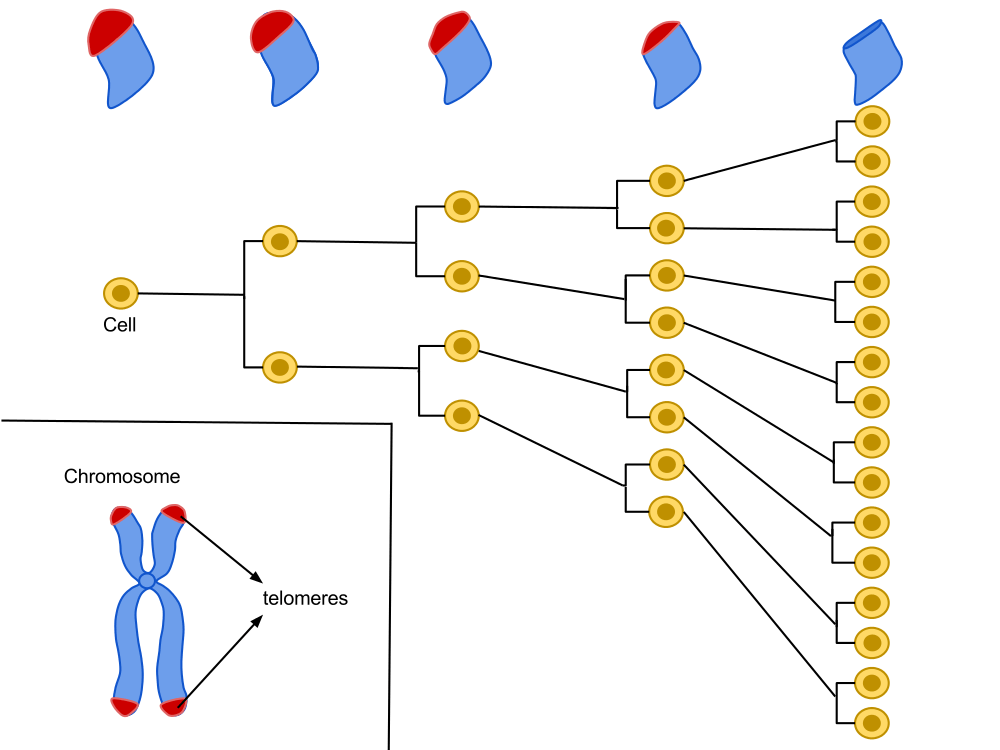
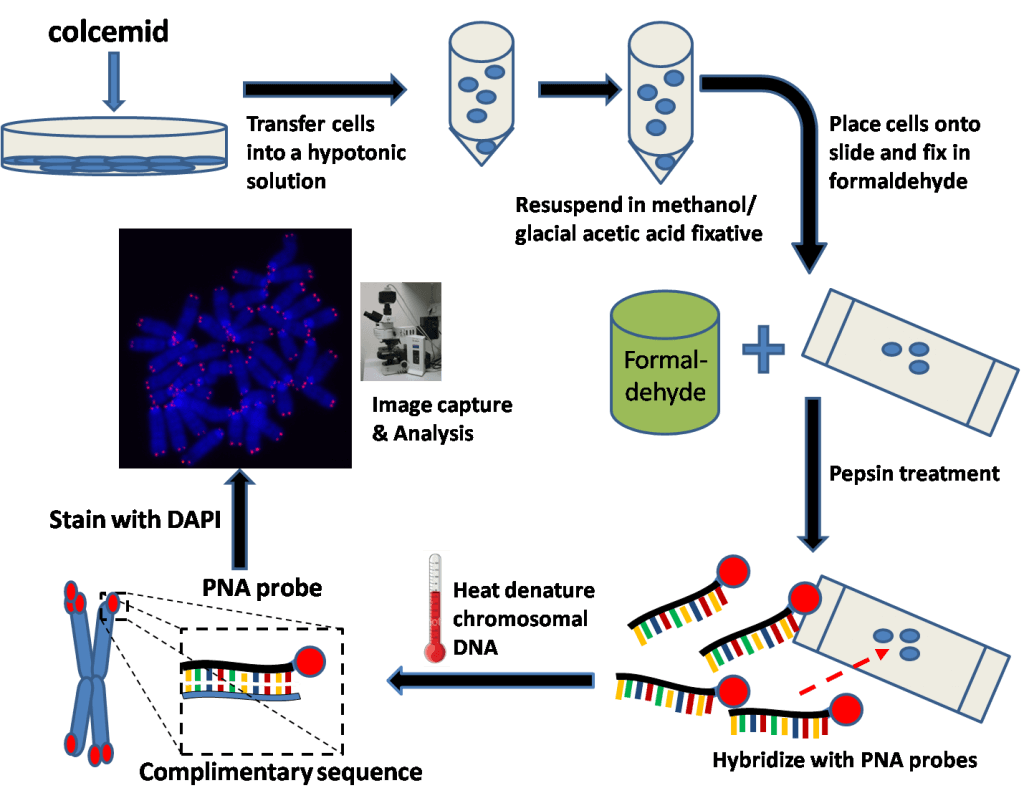
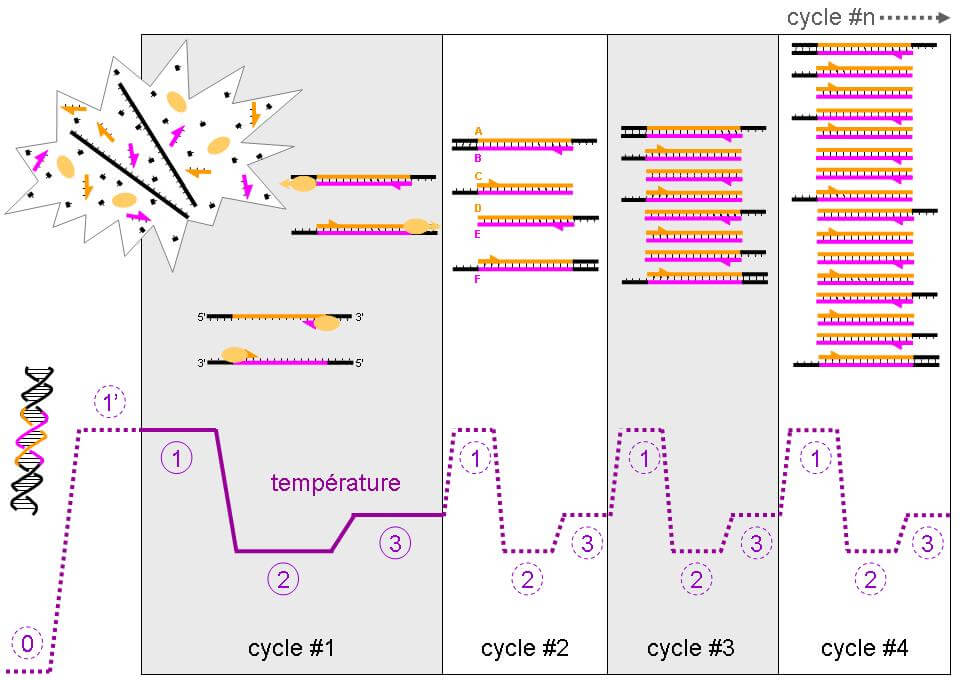


 La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !
La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !