Fight Aging! Extraits
Parce que tout le monde ne comprend pas forcément la langue de Shakespeare, Long Long Life vous fournit une traduction automatique post-éditée des éléments les plus importants de la newsletter Fight Aging!
Fight Aging! fournit un résumé hebdomadaire des actualités et des commentaires pour des milliers d’abonnés intéressés par la science de la longévité: progrès en matière de contrôle médical du vieillissement afin de prévenir la vulnérabilité, la souffrance et les maladies liées à l’âge, ainsi que pour fournir des améliorations dans la compréhension actuelle de ce qui fonctionne et ce qui ne fonctionne pas lorsqu’il s’agit de prolonger une vie saine. Attendez-vous à voir des résumés des récents progrès de la recherche médicale, des nouvelles de la communauté scientifique, des initiatives de collecte de fonds pour accélérer le travail sur la réparation et l’inversion du vieillissement, des liens vers des ressources en ligne, et bien plus encore.
Ce contenu est publié sous la licence Creative Commons Paternité 4.0 International License. Nous vous encourageons à le republier et à le réécrire comme bon vous semble, la seule condition étant de fournir une attribution et un lien vers Fight Aging!
Pour vous abonner ou vous désabonner, veuillez visiter: https://www.fightaging.org/newsletter/
- Réflexions oisives sur la réaction de la classe politique quand elle réalisera que les thérapies de rajeunissement sont imminentes
- Les lésions mutagènes dans les cellules cérébrales à longue durée de vie sont corrélées avec l’âge
- La plasma jeune améliore la fonction hépatique chez les rats âgés en stimulant l’autophagie
- Encore plus de preuves d’une altération du drainage du liquide céphalorachidien dans le vieillissement
- Récepteurs de mort cellulaire comme biomarqueurs de la mortalité cardiovasculaire
- Une discussion sur la sénescence cellulaire dans la dégénérescence maculaire liée à l’âge
- La fondation SENS commente la recherche de Calico sur le rajeunissement apparent des ovocytes
- La sénescence cellulaire et le déclin des cellules souches dans l’hypertrophie cardiaque liée à l’âge et causée par l’hypertension artérielle
Réflexions oisives sur la réaction de la classe politique quand elle réalisera que les thérapies de rajeunissement sont imminentes
L’establishment politique est un fléau sur la terre; c’est généralement vrai de toute époque. Nous avons la chance de vivre à une époque où le niveau d’impact est moins brutal et plus bureaucratique qu’il ne l’ a été, et dans une région où le niveau de richesse est suffisamment élevé pour permettre à la plupart des gens de vivre confortablement malgré les guerres constantes et le vaste gaspillage des pouvoirs. Il y a, ce qui est important, suffisamment d’espace dans notre société laissée libre et incontrôlée pour que le développement technologique se fasse à un rythme raisonnable. La technologie détermine à peu près tout sur nos vies, la mesure dans laquelle elles valent la peine d’être vécues, la forme de nos sociétés et le rythme auquel nous vieillissons jusqu’ à la mort. Un progrès plus rapide est une grande et merveilleuse chose. Pourtant, tôt ou tard, les nouvelles technologies deviennent suffisamment prometteuses pour attirer l’attention des milieux politiques, et les défis du développement se transforment alors en défis pour repousser les diverses formes de banditisme et de sabotage, subtiles et moins délicates.
J’ai remarqué l’article ci-dessous dans la presse politique d’aujourd’hui; il est étonnamment bien documenté dans ses détails, si ce n’est certains de ses prémisses, compte tenu de la source. Le journalisme politique est à peu près le pire de l’industrie de la presse, et le « pire » dans ce contexte est devenu une barre très basse de ces derniers temps; la propagande stentorienne du passé a cédé la place à une sorte d’hystérie de masse. En ce qui concerne l’article ici – si nous commençons à voir davantage de ce genre de choses, répétées plus souvent, cela pourrait marquer le début d’un établissement interventionniste en matière de science de la longévité. Ce n’est probablement pas quelque chose dont il faut se réjouir: le premier instinct de cet établissement est de mettre un terme à toute forme de changement, le second est de taxer tout ce qui est nouveau, quels que soient les dommages causés, et le troisième est de restreindre et de contrôler l’accès, en le limitant à ceux qui ont des connexions.
Lorsque l’attention de l’établissement se traduit par un financement arraché au pool généré par la taxation involontaire et consacré à une cause spécifique, ces fonds sont invariablement largement détournés vers des activités et des déchets inutiles, ou utilisés pour soutenir des activités non connexes menées par les politiquement liés. Voyez le peu que l’US National Institute on Aging a accompli au cours des vingt dernières années: tant de financements, tant d’études, tant de programmes, et où sont les résultats en termes d’années de vie humaine gagnées? L’espérance de vie résiduelle à 60 ans a progressé très lentement dans une tendance sans rapport avec les dépenses publiques de recherche. La philanthropie, les organismes de bienfaisance et les entreprises en démarrage qui utilisent une infime fraction du budget de la NIA, fondée sur des données scientifiques suffisamment explorées pour pouvoir commencer il y a trente ans, permettront d’assurer l’avenir de nouvelles années de vie saine.
Pendant ce temps, le premier instinct des propagandistes de la presse politique est de se demander comment une amélioration de la souffrance des personnes âgées pourrait affecter l’équilibre des votes ou le paiement des droits, les partis politiques ou la réglementation en vigueur. On a l’impression que les gens, la souffrance, la mort n’ont pas tant d’importance à leurs yeux, si ce n’est la façon dont ils sont vus à distance de la ville sur la colline. Je trouve ça moche.
Nous pourrions faire pire que d’éviter tous les politiciens et leurs créatures, et de travailler à faire le bien que nous voulons voir dans le monde nous-mêmes. Cependant, l’establishment politique exploite et prospère en cooptant nos pires instincts et, comme le montre l’état actuel du monde, cette stratégie est très efficace. En tant que choix de vie, je vous conseille de lire plus Thoreau et Spooner et moins de la presse telle qu’elle est aujourd’hui – des conseils qui étaient sans doute tout aussi pertinents il y a quelques siècles qu’aujourd’hui. S’engager avec l’establishment politique est un calice empoisonné, qui entraîne les productifs et les ennoblit dans un système qui ne fait que produire du gaspillage et de la moquerie. Le vrai travail est fait ailleurs.
Pourquoi un médicament pour le vieillissement mettrait-il Washington au défi?
Que se passerait-il si vous pouviez vivre jusqu’ à 85, 90 ou même 100 ans avec vos facultés mentales intactes, capables de vivre de façon autonome sans conditions débilitantes jusqu’ à la dernière année de votre vie? Et si un seul traitement médical pouvait éviter une poignée de maladies terrifiantes comme les maladies cardiaques, le cancer et la maladie d’Alzheimer? L’idée d’une pilule contre le vieillissement ressemble à de la science-fiction ou de la fantaisie. Mais la chasse est de plus en plus réelle. L’approche dominante a même un nom: les médicaments sénolytiques. La science est encore loin d’être prouvée, mais la perspective d’un médicament pour vieillir en meilleure santé a déjà attiré des investissements importants de la part d’entreprises pharmaceutiques bien connues, et les premières études humaines sur les médicaments anti-vieillissement sont en cours. Si les résultats sont concluants, les premiers médicaments pourraient être disponibles en seulement une décennie.
Toutefois, au fur et à mesure que la recherche progresse, elle soulève une série de nouvelles questions auxquelles la médecine et les organismes de réglementation devront faire face. Et les questions les plus complexes se posent exactement autour de la question qui rend le domaine si passionnant: la notion de traitement du processus de vieillissement lui-même. Il n’ y a jamais eu de médicament pour le vieillissement en partie parce que le « vieillissement » n’est pas considéré comme une maladie par la FDA. Devrait-il en être ainsi? Quels sont les signes et symptômes du vieillissement? Et si un médicament était approuvé pour le vieillissement – quelque chose que tout être humain éprouve – qui prendrait en charge les coûts d’une pilule qui pourrait potentiellement être prescrite à chaque personne vivante? Et ce ne sont pas les seules questions. Il s’avère que l’évaluation de la science est également complexe, en partie parce qu’il est difficile de déterminer si un médicament change fondamentalement le cours du vieillissement humain. C’est aussi une question d’éthique: le vieillissement est un processus humain normal, donc l’essai d’un médicament pour le « vieillissement » signifie que des personnes en bonne santé seraient autrement soumises à ses effets secondaires inévitables, pour des avantages non prouvés. Combien de temps un procès serait-il même nécessaire? Les organismes de réglementation ne sont pas près de répondre à ce genre de question.
Jusqu’ à présent, les scientifiques se penchent sur bon nombre de ces questions compliquées en testant ces médicaments uniquement chez des personnes très malades et en étudiant s’ils aident à traiter des maladies mortelles avec peu d’autres options thérapeutiques. L’idée est de faire approuver d’abord un médicament anti-vieillissement potentiel dans le cadre de protocoles plus traditionnels sans avoir à s’attaquer aux questions plus épineuses et à plus long terme soulevées par l’idée de traiter le « vieillissement ». Cependant, il est peu probable que les médecins attendent des réponses aux questions plus générales concernant ces médicaments avant de commencer à les prescrire aux patients. Dès qu’un sénolytique ou un autre médicament anti-vieillissement est approuvé à quelque fin que ce soit, les médecins peuvent commencer à le prescrire à leurs patients pour n’importe quelle condition qu’ils veulent, et probablement le feront.
La science anti-âge a longtemps été considérée avec scepticisme, une science « douce » plus souvent la province des charlatans vendant des potions douteuses que les chercheurs médicaux sérieux. Mais les médicaments sénolytiques sont en train de changer cela. L’idée qui les sous-tend est d’attaquer les cellules sénescentes ou » zombie » – des cellules qui ont cessé de se diviser, mais qui ne sont pas mortes. Les cellules sénescentes libèrent des composés toxiques et inflammatoires qui altèrent le fonctionnement des cellules saines, et les scientifiques croient qu’ils contribuent à entraîner le déclin des tissus corporels importants, comme les organes. Les scientifiques ont découvert que le nombre de cellules sénescentes augmente avec le vieillissement chez les souris, les singes et les humains; elles sont associées à des maladies chroniques comme le diabète, les maladies cardiaques, le cancer, l’arthrite et la fragilité générale. Chez les petits mammifères, les scientifiques ont découvert que l’élimination des cellules sénescentes retarde et prévient de nombreuses affections et maladies liées à l’âge. Dans les essais sur les animaux, les agents sénolytiques ont également traité avec succès des affections telles que la dysfonction cardiaque, les maladies pulmonaires, le diabète, l’ostéoporose et les dommages causés par les radiations. Il a même été démontré que le nettoyage des cellules sénescentes des souris adultes augmente la durée de vie médiane.
Il ne sera pas facile d’interpréter les résultats des études sur le vieillissement humain. Pour prouver qu’un médicament prévient le vieillissement, les entreprises devront finalement trouver des changements chez des personnes qui ne sont pas touchées par la maladie. Par exemple, la peau se ride et perd de son élasticité au fil des ans, mais cela ne cause pas de maladie. La masse musculaire diminue également avec l’âge. Si une entreprise peut démontrer que le médicament modifie ces changements, »c’est un bon argument que vous avez une incidence sur le vieillissement ». Mais le potentiel d’approbation des médicaments anti-vieillissement sur la base de ces indicateurs déclenche déjà l’alarme des bioéthiciens. Ils craignent que les pressions exercées par les entreprises pour que ces médicaments soient approuvés rapidement ne conduisent à exposer les patients à des médicaments qui n’offrent que des avantages superficiels – et éventuellement à des dommages cachés. Cette préoccupation à l’égard de la « dérive des indications » – la tendance à prescrire des médicaments pour des problèmes qu’ils n’étaient pas autorisés à traiter – est un autre déclencheur pour les éthiciens. Bon nombre des entreprises qui testent les premiers médicaments sénolytiques n’essaient pas de les faire approuver pour le vieillissement, mais ciblent plutôt des maladies pour lesquelles elles croient que les cellules sénescentes jouent un rôle.
En raison de l’enthousiasme suscité par les médicaments, les chercheurs s’inquiètent déjà des récits anecdotiques de gens qui veulent utiliser les médicaments pour traiter le vieillissement avant l’heure de pointe. Paul Robbins de l’Institut Scripps a dit que certains sénolytiques sont des produits naturels ou des médicaments de chimiothérapie plus anciens. Il a entendu parler de cliniques déjà mises en place à l’étranger pour fournir des médicaments comme ceux-là comme traitements anti-vieillissement, même sans preuve qu’ils fonctionnent, ou des données sur la bonne posologie. Le battage médiatique est dangereux, prévient James Kirkland, dont l’employeur, la clinique Mayo, investit dans les sénolytiques. « Tout peut mal tourner en cours de route. Si vous pouviez mettre en garde vos lecteurs, dites-leur de ne pas prendre ces médicaments avant d’avoir fait les essais, car c’est une nouvelle façon de faire les choses. Nous ne savons pas s’ils vont fonctionner et nous ne savons pas quels sont les effets secondaires. »
« Si vous démontrez que ces médicaments sont efficaces, tout le monde voudra probablement en prendre. La question devient alors une question de coût », a déclaré Steven Austad, directeur scientifique de l’American Federation for Aging Research. Un médicament à prix élevé pris par tout le monde pourrait imposer un fardeau à un système de soins de santé déjà surchargé, qui devrait probablement payer pour que tout le monde prenne ce médicament pendant des décennies. Et plus les gens vivent longtemps, plus ils tireront profit des programmes de prestations du gouvernement. « Politiquement, c’est un sujet brûlant », a déclaré Laura Niedernhofer de l’Institut de recherche Scripps. « Quelqu’un qui ne creuse pas profondément pense immédiatement: » Oh mon Dieu, la durée de vie va s’allonger et la Sécurité Sociale est déjà en mauvaise posture, et comment allons-nous gérer ça? » Niedernhofer est optimiste, cependant, en affirmant que les coûts des thérapies anti-vieillissement vont plus que se payer d’eux-mêmes, leurs coûts compensés par le fait que les gens en meilleure santé auront besoin de moins de soins médicaux dans les dernières années de leur vie.
Selon Leigh Turner, bioéthicienne de l’Université du Minnesota, une autre préoccupation est de pousser les ressources vers une idée qui n’ a pas fait ses preuves, plutôt que vers des programmes de santé publique éprouvés qui ont déjà prouvé qu’ils prolongent la vie et améliorent la santé, comme l’approvisionnement en eau potable ou une meilleure gestion des déchets. Mais » rien dans notre monde n’est équitablement réparti – pas d’argent, pas de nourriture, pas d’eau « , s’oppose S. Jay Olshansky, qui étudie le vieillissement à l’Université de l’Illinois à la Chicago School of Public Health. Ces inégalités ne sont pas une excuse pour cesser de poursuivre une idée qui pourrait améliorer la santé de tous. Et le coût élevé potentiel ne devrait pas arrêter la recherche, dit-il: les pays riches ont poursuivi un grand nombre d’interventions coûteuses dans le domaine de la santé qui n’étaient pas abordables au départ, ou qui ne le sont toujours pas dans certaines parties du monde en développement.

Les lésions mutagènes dans les cellules cérébrales à longue durée de vie sont corrélées avec l’âge
Les dommages dus aux mutations aléatoires de l’ADN nucléaire sont-ils une cause importante du vieillissement? Le consensus au sein de la communauté scientifique sur cette question est qu’il s’agit d’une cause importante, la théorie étant que cela entraîne un changement suffisant dans la production de protéines et le comportement cellulaire pour produire une dégradation fonctionnelle. Ce consensus est toutefois remis en question et, à l’heure actuelle, il y a un manque flagrant de preuves à l’appui pour l’une ou l’autre de ces positions, même si l’on en juge par quelques études intéressantes de ces dernières années. Il est bien connu que le niveau de mutation est corrélé avec l’âge, et les méthodes de ralentir le vieillissement ralentissent également l’augmentation des dommages mutagènes. Ainsi, chaque aspect du vieillissement tend en fait à être corrélé avec la charge de mutation, mais cela ne nous renseigne pas nécessairement sur la cause et l’effet – et c’est le cas ici.
Le vieillissement chez l’homme entraîne une incidence accrue de presque toutes les maladies, y compris les maladies neurodégénératives. On a longtemps émis l’hypothèse que le vieillissement et la neurodégénérescence sont associés à la mutation somatique dans les neurones; cependant, des obstacles méthodologiques ont empêché de vérifier directement cette hypothèse. Les marqueurs de dommages d’ADN augmentent dans le cerveau avec l’âge, et les maladies génétiques de progeroid causées par des défauts dans la réparation de dommages d’ADN (DDR) sont associées à la neurodégénérescence et au vieillissement prématuré. Ici, nous avons examiné quantitativement si le vieillissement ou les troubles de DDR défectueux entraînent des mutations plus somatiques dans les neurones humains postmitotiques uniques.
Les mutations somatiques qui se produisent dans les neurones postmitotiques sont uniques à chaque cellule et ne peuvent donc être analysées de façon exhaustive qu’en comparant les génomes des cellules individuelles. Par conséquent, nous avons analysé les neurones humains par séquençage du génome entier à cellules uniques (WGS). Comme les altérations du cortex préfrontal ont été liées au déclin cognitif lié à l’âge et aux maladies neurodégénératives, nous avons analysé 93 neurones du cortex préfrontal (PFC) de 15 individus neurologiquement normaux âgés de 4 mois à 82 ans. Nous avons également examiné 26 neurones de l’hippocampe dentate gyrus (DG) de 6 de ces personnes parce que le DG est un point focal pour d’autres maladies dégénératives liées à l’âge comme la maladie d’Alzheimer. Enfin, pour vérifier si un DDR défectueux dans les maladies neurodégénératives à apparition précoce est associé à une augmentation des mutations somatiques, nous avons analysé 42 neurones PFC de 9 personnes atteintes du syndrome de Cockayne (CS) et du Xeroderma pigmentosum (XP).
Notre analyse a révélé que la variante somatique d’un seul nucléotide (SNNVs) s’accumulait lentement mais inexorablement avec l’âge dans le cerveau humain normal, un phénomène que nous appelons génosenium, et plus rapidement encore dans la neurodégénérescence progéroïde. Moins d’un an après la naissance, les neurones postmitotiques ont déjà ~300-900 sSNVs. Trois signatures ont été associées aux processus de mutations dans les neurones humains: une signature postmitotique ressemblant à une horloge du vieillissement, une signature possiblement développementale qui variait selon les régions du cerveau, et une signature spécifique à la maladie et à l’âge de l’oxydation et de la réparation des dommages causés par l’ADN défectueux. L’augmentation des mutations oxydatives du vieillissement et de la maladie constitue une cible potentielle d’intervention thérapeutique. De plus, l’élucidation des fondements mécanistes de l’accumulation de mutations semblables à une horloge dans les régions du cerveau et d’autres tissus augmenterait notre connaissance des maladies liées à l’âge et du déclin cognitif. CS et XP provoquent une neurodégénérescence associée à des taux plus élevés de SSNV, et il sera important de définir comment d’autres causes plus courantes de neurodégénérescence peuvent également influencer le génosenium.
Le plasma jeune améliore la fonction hépatique chez les rats âgés en stimulant l’autophagie
Les recherches menées ici montrent que les injections de plasma sanguin de jeunes rats améliorent l’autophagie et la fonction hépatique chez les rats âgés. C’est intéressant étant donné les preuves jusqu’ à présent mitigées selon lesquelles le transfert de plasma des jeunes vers les personnes âgées est bénéfique. Cependant, il existe un historique de recherche qui montre que l’augmentation des niveaux des processus cellulaires d’entretien de l’autophagie peut améliorer la fonction hépatique chez les rongeurs âgés. L’autophagie diminue normalement avec l’âge, ce qui semble contribuer à divers problèmes, comme la perte d’activité des cellules souches. Vous vous souviendrez peut-être que l’augmentation du nombre de récepteurs sur les lysosomes chez les rats âgés peut améliorer la fonction hépatique; les lysosomes sont la partie de l’infrastructure autophagique qui décompose les protéines et les structures endommagées, et ils fonctionnent plus efficacement lorsqu’ils sont équipés de récepteurs plus nombreux.
La stratégie de transfusion de plasma de jeunes à vieux est une conséquence de la recherche sur la parabiose dans laquelle les systèmes circulatoires d’un individu jeune et vieux sont liés. Cela aggrave les indicateurs de vieillissement chez les jeunes et les améliore chez les personnes âgées. L’opinion actuelle dans le milieu de la recherche est partagée entre l’hypothèse que les facteurs dans le sang des jeunes améliorent la fonction des cellules et des tissus, ou que les facteurs dans le sang vieux endommagent la fonction des cellules et des tissus. Il y a des preuves pour les deux côtés, et l’équilibre a fluctué d’un côté et de l’autre au cours des dernières années.
L’étude ajoute ici quelque chose de nouveau, c’est-à-dire que la preuve des effets bénéfiques du transfert plasmatique doit être principalement médiée par une augmentation de l’autophagie, du moins dans le foie. Cela a été démontré pour la restriction calorique et un certain nombre de méthodes connexes pour ralentir modestement le processus de vieillissement chez les espèces de laboratoire – l’autophagie est clairement importante dans la hiérarchie des systèmes biologiques qui déterminent la relation entre les circonstances environnementales et les variations naturelles du rythme de vieillissement. Étant donné que ces approches ne parviennent pas à prolonger la vie chez les humains et d’autres espèces à longue durée de vie à un degré aussi élevé que chez les espèces à courte durée de vie, on pourrait supposer que la même relation malheureuse s’appliquera ici. La parabiosis pourrait s’avérer être juste une autre manière de manipuler certaines des réactions cellulaires bénéfiques à la restriction de calorie, atteignant les mêmes résultats pauvres sur la durée de vie chez les humains, mais probablement encore un degré utile d’autres avantages pour la santé.
Des études récentes montrant l’effet thérapeutique du sang jeune sur la détérioration des organes liée au vieillissement indiquent que le sang jeune est la solution aux problèmes cliniques liés à la vieillesse. Étant donné que l’autophagie défectueuse a été impliquée dans le vieillissement et les lésions des organes associées au vieillissement, cette étude a été conçue pour déterminer l’effet du sang jeune sur les altérations de la fonction hépatique et des mécanismes sous-jacents induites par le vieillissement, en mettant l’accent sur l’autophagie.
Les rats âgés (22 mois) ont été traités avec du plasma mélangé (1 ml, par intraveineuse) prélevé sur des rats jeunes (3 mois) ou âgés trois fois par semaine pendant quatre semaines, et de la 3-méthyladénine ou de la wortmannine a été utilisée pour inhiber l’autophagie induite par le sang chez les jeunes rats. Le vieillissement était associé à des taux élevés d’alanine transaminase et d’aspartate aminotransférase, d’accumulation de lipofuscine, de stéatose, de fibrose et de régénération hépatique défectueuse après hépatectomie partielle, qui ont été atténués de façon significative par de jeunes injections plasmatiques.
Le plasma jeune pourrait également rétablir l’activité autophagique altérée par le vieillissement, tandis que l’inhibition de l’activité autophagique restaurée par le plasma jeune a annulé l’effet bénéfique du plasma jeune contre les lésions hépatiques causées par le vieillissement. In vitro, le jeune sérum pouvait protéger les hépatocytes âgés contre la sénescence, et l’effet antisénescence du jeune sérum a été abrogé par la 3-méthyladénine, la Wortmannine ou un petit ARN interférant dans la protéine 7 autophagique. Collectivement, nos données indiquent que le plasma juvénile pourrait améliorer partiellement les altérations de la fonction hépatique liées à l’âge, en partie grâce à la restauration de l’autophagie.
Encore plus de preuves d’une altération du drainage du liquide céphalorachidien dans le vieillissement
Leucadia Therapeutics est l’une des jeunes entreprises dirigées par le Methuselah Fund, qui travaille dans ce cas-ci sur un traitement de la maladie d’Alzheimer basé sur une théorie de la maladie qui considère l’altération du drainage du liquide céphalo-rachidien comme une cause importante. La maladie d’Alzheimer est une maladie caractérisée par l’accumulation d’agrégats protéiques, et l’une des façons dont le cerveau élimine normalement ces agrégats est par le drainage du liquide céphalorachidien dans le corps. Les passages pour ce drainage, comme la plupart des autres systèmes corporels, échouent avec le temps. Au cours des dernières années, de plus en plus de preuves liant cette maladie à l’âge sont apparues.
Dans l’exemple ici, les chercheurs arrivent à la conclusion qu’il y a un défaut de drainage du liquide céphalorachidien à partir d’une position tout à fait différente, l’étude de l’hydrocéphalie, ou l’accumulation excessive de liquide céphalorachidien dans le cerveau. Cela n’est pas rare chez les personnes âgées, et il y a un chevauchement marqué avec la maladie d’Alzheimer – il n’est pas difficile de relier les points entre ces deux domaines de recherche. Les données probantes pour l’une tendent à appuyer l’autre, et les divers groupes de recherche qui explorent la physiologie du drainage dans le cerveau peuvent bien finir par converger vers la même destination.
Les syndromes de troubles neurologiques progressifs dans le réglage de la pression normale du liquide céphalo-rachidien (LCR) ont été qualifiés d’hydrocéphalie à pression normale (NPH). Les patients qui ne présentent pas de facteurs de précipitation connus reçoivent un diagnostic de NPFS idiopathique (iNPH), dont le mécanisme demeure largement inconnu. Cependant, la forte augmentation de l’incidence de l’iNPH chez les personnes âgées de 60 ans et plus suggère une association avec le vieillissement. Certaines études récentes ont mis l’accent sur le rôle principal des modifications anormales du drainage hydrique et sanguin ou de la viscoélasticité dans le parenchyme cérébral en tant que mécanismes probables du développement de la maladie lié à l’âge.
Néanmoins, depuis les premiers signalements, l’amélioration immédiate des symptômes à la suite de l’ablation du LCR par une ponction lombaire n’ a pas seulement été utile à des fins cliniques, mais a également suggéré que la perfusion anormale est la cause directe des manifestations cliniques. Malgré l’ensemble des données probantes démontrant des changements dans le débit sanguin à la suite de l’examen par prélèvement, il n’existe pas de critères diagnostiques établis fondés sur l’imagerie du débit sanguin. Il est essentiel que l’iNPH soit diagnostiqué suffisamment tôt pour permettre le détournement du LCR à l’aide d’un shunt, le cas échéant, afin de prévenir des dommages irréversibles. Il est donc nécessaire de recourir à des techniques novatrices et non invasives pour évaluer cet état de santé chez les personnes âgées.
Récemment, la cartographie de la phase de basse fréquence dans une série temporelle de signaux dépendants du niveau d’oxygénation du sang (BOLD) a été proposée comme biomarqueur cliniquement utile dans les maladies cérébrovasculaires. Dans la présente étude, nous avons fait l’acquisition de l’imagerie par résonance magnétique (IRM) BOLD à l’état de repos avant et après une TT rachidienne, et comparé les cartes de décalage BOLD pour évaluer l’effet du traitement sur la perfusion cérébrale chez des sujets atteints de iNPH.
Nous avons observé une phase anormale dans la région périventriculaire où les veines profondes convergent. Dans des conditions saines, la phase ou le temps de drainage relatif dans cette région présentait systématiquement une phase veineuse tardive. Ce temps de drainage anormalement long, ou temps d’évaporation en iNPH, a été normalisé par TT, alors que la moyenne globale de la phase est restée stable. Collectivement, ces résultats permettent d’interpréter qu’une partie du système veineux profond est drainée par des collatéraux en iNPH au lieu de la voie normale via les veines cérébrales internes. Le changement général après le TT peut refléter la normalisation de cet état, ce qui implique une modification du réseau de drainage. Des altérations du drainage veineux ont été observées dans les NPH chroniques et la zone périventriculaire peut être l’un des sites fréquemment affectés par cette inefficacité veineuse.
Le fait que le vieillissement normal et les anomalies de l’iNPH (corrigé par TT) impliquent une insuffisance veineuse profonde peuvent avoir des implications étiologiques, car cela suggère un drainage veineux altéré en l’absence de dilatation ventriculaire pathologique. Par conséquent, par exemple, une relation de cause à effet entre l’hydrocéphalie et l’œdème périventriculaire peut être mise en doute. Elle peut également impliquer un rôle déclencheur de la congestion veineuse dans la réduction de la conformité cérébrale qui se développe au cours des processus pathologiques et du vieillissement. Bien que le concept d’inefficacité veineuse en tant que cause de l’hydrocéphalie ne soit pas nouveau, il n’ a pas été lié au vieillissement. Bien que le rôle du LCR dans le mécanisme ne puisse pas être déduit des données actuelles, il est intéressant de noter que les zones touchées englobent des régions liées au renouvellement du LCR.
Récepteurs de mort cellulaire comme biomarqueurs de la mortalité cardiovasculaire
Les chercheurs présentent ici des preuves que les récepteurs de mort cellulaire, dont le nom est approprié, sont des biomarqueurs du risque de maladie cardiovasculaire, une mesure indirecte des dommages qui s’accumulent dans le système vasculaire au cours du vieillissement, et de ses effets sur la biochimie cellulaire. Le milieu de la recherche cherche à établir des biomarqueurs fiables et facilement mesurables qui se rapportent aux maladies liées à l’âge, à la mortalité et aux mécanismes connus du vieillissement. Plus il y en a, plus il est probable que ces biomarqueurs puissent être combinés d’une manière algorithmique pour générer un biomarqueur global plus précis de l’âge biologique – quelque chose qui peut être utilisé pour évaluer rapidement la performance des premières thérapies de rajeunissement, à mesure qu’elles arrivent, et pour orienter leur développement.
Les récepteurs de mort cellulaire sont activés, par exemple, dans le cas d’infections lorsque les globules blancs qui ont combattu un virus doivent être éliminés. On savait auparavant que les récepteurs de mort cellulaire peuvent être mesurés dans le sang , mais on ne savait pas si un taux élevé était lié à une augmentation de la mort cellulaire dans le diabète de type 2 et l’artériosclérose. L’objectif de l’étude était donc d’examiner si les « récepteurs de mort » pouvaient être utilisés comme marqueurs liés à des lésions tissulaires continues et s’ils pouvaient être utilisés pour prédire le risque de développer des maladies. Les résultats montrent que l’augmentation de la mortalité cellulaire peut être liée à l’augmentation des taux sanguins de trois membres différents d’une même « famille de récepteurs de mort cellulaire » (TNFR-1, TRAILR-2 et Fas). Une augmentation de la mort cellulaire est observée chez les diabétiques de type 2 ainsi que chez les personnes atteintes d’artériosclérose.
L’hyperglycémie et les graisses sanguines (faible taux de HDL, »le bon cholestérol ») soumettent les vaisseaux sanguins et les cellules bêta productrices d’insuline à un stress. Le stress à long terme endommage les cellules et peut provoquer la mort des récepteurs à la surface de la cellule pour déclencher un programme de suicide cellulaire à l’intérieur de la cellule. « Lorsque les cellules bêta sont endommagées, la production d’insuline diminue, ce qui augmente le risque de diabète. Les dommages provoquent des processus de réparation dans les vaisseaux sanguins. Si elles ne sont pas correctement résolues, cela conduit généralement au développement de plaque dans les vaisseaux sanguins (artériosclérose). La formation de fissures dans cette plaque est la cause principale de l’infarctus du myocarde et de l’accident vasculaire cérébral. »
L’étude a également examiné les liens entre différents facteurs de risque – l’âge, l’IMC, les graisses sanguines, la glycémie et la tension artérielle – et les récepteurs de la mort TNFR-1, TRAILR-2 et Fas dans des échantillons de sang prélevés sur 4 742 personnes faisant partie de l’étude de population Malmö Diet Cancer. Les échantillons des années 1990 ont été comparés au risque de diabète, de crise cardiaque et d’accident vasculaire cérébral au cours des 20 prochaines années. Les résultats montrent des liens évidents entre le niveau des récepteurs de la mort dans le sang et les différents facteurs de risque. Les taux élevés de récepteurs de mort étaient fréquents chez les diabétiques, ce qui indique une augmentation du stress cellulaire et un risque de lésions aux différents organes. Chez les non-diabétiques, des taux élevés de récepteurs de la mort ont été associés à un risque accru de diabète et de maladies cardiovasculaires. Cela indique que le niveau des récepteurs de mort cellulaire dans le sang reflète les dommages causés par les facteurs de risque dans différents organes.
Une discussion sur la sénescence cellulaire dans la dégénérescence maculaire liée à l’âge
La sénescence cellulaire est l’une des causes profondes du vieillissement. Une petite fraction du grand nombre de cellules qui deviennent sénescentes chaque jour ne parviennent pas à s’autodétruire et restent dans les tissus pour sécréter un mélange de signaux inflammatoires et d’autres signaux nocifs. Ce comportement est connu sous le nom de phénotype sécrétoire associé à la sénescence, ou SASP. Le nombre considérable de cellules sénescentes dans les vieux tissus a été impliqué comme une cause contributive de nombreuses affections liées à l’âge, des maladies pulmonaires aux problèmes cardiovasculaires en passant par les formes d’arthrite. D’autres liens de causalité seront découverts: il s’agit d’un nouveau champ de recherche énergétique.
À titre d’exemple du type de réflexion en cours, les chercheurs discutent ici d’un rôle potentiel de la sénescence cellulaire dans la dégénérescence maculaire, une cécité progressive causée par la destruction du tissu rétinien. Bien qu’il semble assez probable que les cellules sénescentes soient impliquées, la question est toujours de savoir si elles le sont suffisamment pour en être une cause importante. Cela semble plausible d’après ce qui est connu, mais il ne s’agit pas d’un cas ouvert et fermé. Il existe une incertitude considérable, sur la base des preuves existantes. Heureusement, maintenant que les thérapies sénolytiques pour nettoyer les cellules sénescentes sont une préoccupation constante, il y a une façon assez rapide d’en apprendre davantage: retirer les cellules sénescentes des modèles animaux âgés de dégénérescence maculaire et voir ce qui se passe. Quelqu’un s’en occupera dans les prochaines années, j’imagine.
La dégénérescence maculaire liée à l’âge (DMLA) est la principale cause de cécité dans les pays développés. Le vieillissement est le principal facteur de risque de la DMLA, mais c’est une maladie complexe dans laquelle les facteurs génétiques et environnementaux jouent un rôle. Le mécanisme exact de sa pathogenèse est inconnu. Le stress oxydatif, l’agrégation protéique et l’inflammation jouent un rôle central dans le développement de la DMLA. La DMLA sèche précoce est à peine détectable et habituellement asymptomatique. Sa forme avancée, appelée atrophie géographique (GA), est associée à une perte massive de photorécepteurs qui évoque une perte visuelle centrale. Une des caractéristiques cliniques de la DMLA humide est la présence de vaisseaux néovasculaires qui jaillissent des choriocapillaires dans la rétine.
Il a été proposé que la sénescence cellulaire des cellules EPR joue un rôle dans l’étiologie de la DMLA. Il semble que de nombreuses études sur le rôle de la sénescence cellulaire dans le vieillissement de l’organisme et les pathologies liées à l’âge appuient cette idée. L’exposition des cellules à un stress non létal récurrent ou chronique pourrait contribuer à une augmentation de l’accumulation de cellules sénescentes induites par le stress, accélérant ainsi le vieillissement tissulaire. Un corpus croissant de preuves prouve que les dommages persistants à l’ADN, en particulier les cassures à double brin (DSB) et la réponse aux dommages à l’ADN (DDR), sont étroitement associés à la sénescence cellulaire. Les données probantes établissent également un lien entre les lésions de l’ADN et l’inflammation et la maladie, en particulier les maladies liées à l’âge. Il s’agit en quelque sorte d’un cercle vicieux, car la sénescence dépendante de l’ADN peut conduire à la sécrétion de molécules, ce qui peut renforcer la sénescence et provoquer des dommages à l’ADN et la sénescence dépendante de l’ADN.
Les cellules épithéliales pigmentaires rétiniennes épithéliales (RPE) de la rétine centrale sont en état de repos, et lorsqu’elles sont endommagées, elles peuvent être remplacées par leurs homologues proliférants à la périphérie de la RPE. Le stress oxydatif peut induire la sénescence dans les cellules RPE et entraîner l’incapacité des cellules RPE périphériques à sauver leurs équivalents RPE centraux, ce qui peut entraîner une perte massive des cellules RPE observées dans la DMLA cliniquement détectée. Si la plupart des cellules de l’EPR périphérique maculaire sont affectées par la sénescence, ce mécanisme peut échouer et mener à la DMLA. L’EPR sénescente sera la source de la pathologie et aura un effet néfaste sur les tissus environnants par le biais du phénotype sécrétoire associé à la sénescence (PSAS).
Nous pensons que la sénescence est associée à l’autophagie et au DDR. Tous ces trois effets, sénescence, autophagie et DDR, peuvent être provoqués par le stress oxydatif, qui est un facteur important de la pathogenèse de la DMLA. De plus, le vieillissement est le principal facteur de risque de la pathogenèse de la DMLA et peut être lié au stress oxydatif. L’inflammation est associée au stress oxydatif, au vieillissement (inflammation) et à la DMLA. Par conséquent, il est logique et justifié de supposer que la sénescence peut jouer un rôle dans la DMLA et que ce processus peut être influencé ou régulé par l’autophagie et le DDR. Par conséquent, le GATA4, en tant que facteur identifié impliqué dans la sénescence cellulaire, l’autophagie, le DDR et l’inflammation, semble être un candidat naturel pour jouer un rôle majeur dans le mécanisme proposé de la pathogenèse de la DMLA. Toutefois, il ne s’agit là que d’une hypothèse, qui doit être vérifiée, mais nous avons essayé de montrer certains arguments selon lesquels ce sujet mérite d’être approfondi et développé.
 La fondation SENS commente la recherche de Calico sur le rajeunissement apparent des ovocytes
La fondation SENS commente la recherche de Calico sur le rajeunissement apparent des ovocytes
La California Life Company, ou Calico, d’ordinaire très secrète, a récemment partagé certaines de ses recherches sur le rajeunissement qui a lieu aux premiers stades du processus de reproduction – les parents sont âgés et les enfants sont jeunes, donc une forme de rajeunissement doit se produire à un moment donné, ou les cellules reproductrices doivent être exceptionnellement bien protégées contre le vieillissement. L’équipe de Calico a montré que dans les nématodes et les grenouilles, les ovocytes ou les ovocytes, lorsqu’ils sont utilisés, subissent une explosion de tâches ménagères cellulaires qui éliminent les protéines endommagées. On pense que quelque chose de semblable se produit dans le développement embryonnaire précoce des mammifères, un processus qui semble également déclenché en partie par la pluripotence induite. Est-ce que tout cela est utile et pertinent aux efforts pour produire des thérapies de rajeunissement? Voici un long commentaire de la Fondation de recherche SENS, dont le fondateur a été l’un des nombreux chercheurs très critiques de Calico Labs dans le passé:
Certains lecteurs ont eu l’impression que cette étude avait mis au jour un mécanisme moléculaire particulier qui permettait aux ovocytes de ces nématodes de rester « jeunes », même si le corps dans son ensemble vieillissait. Cette impression peut avoir été renforcée par une citation d’un chercheur, qui compare le vieillissement du corps humain avec l’immortalité (semblable) de la lignée germinale (la « lignée » des spermatozoïdes et des ovaires qui se transmet de génération en génération): « On prend les humains – ils vieillissent de deux, trois ou quatre décennies, puis ils ont un bébé tout neuf. »
Certains lecteurs en sont repartis avec l’idée que le fait que les bébés naissent jeunes implique la capacité des ovocytes à se « débarrasser » du fardeau des protéines déformées qui pèsent sur leurs parents adultes et espéraient ardemment que les astuces qu’ils utilisent pour exécuter cet exploit pourraient être utilisées sur les cellules vieillissantes ailleurs dans le corps pour garder nos muscles et nos cellules cérébrales jeunes. Malheureusement, aucune de ces astuces n’a émergé de cette étude, et il est peu probable qu’elles le fassent. Cette étude apporte un éclairage substantiel à un corpus de travaux sur la biologie des ovocytes des nématodes (et plus tard des grenouilles) issu d’une découverte faite par des scientifiques français en 2010 et de travaux antérieurs sur la levure et les embryons de souris. Cependant, il n’ y a rien ici qui puisse être exploité pour développer des thérapies anti-âge.
La véritable découverte du papier est mieux illustrée par son propre titre que par les gros titres du journal: »Un commutateur lysosomal déclenche le renouvellement de la protéostase dans la lignée germinale immortelle de C. elegans ». Le mot-clé n’est pas « immortel », mais « renouvellement » – le renouvellement de la « protéostase », le concept quelque peu équivoque du maintien dynamique par la jeune cellule de niveaux stables de protéines endommagées. Il s’avère que le « renouvellement » en question est une réactivation de l’activité « protéostatique » normale du lysosome – le centre de recyclage de la cellule, où les protéines anciennes et endommagées sont décomposées en matières premières qui peuvent ensuite être réutilisées pour construire de nouvelles protéines.
Pendant que les ovocytes sont entreposés, ils adoptent un état de dormance métabolique pour conserver l’énergie et réduire la production de déchets métaboliques. Cela est tout aussi vrai chez les mammifères que chez les vers de terre et les grenouilles étudiés dans ce nouveau rapport. La nouvelle étude a mis au jour une stratégie particulière de conservation de l’énergie que ces animaux utilisent pour leurs ovocytes. Il n’ y a pas de pouvoir régénérateur particulier dans ce processus: d’autres cellules nettoient régulièrement ces mêmes déchets au lieu de les laisser s’accumuler jusqu’ à ce qu’il soit absolument nécessaire de s’en débarrasser.
Malgré les efforts que le corps déploie pour ne conserver que des oeufs « jeunes » viables, les ovocytes parviennent quand même à dégénérer avec l’âge, ce qui explique en partie pourquoi les parents plus âgés sont moins fertiles. Le bon côté de toutes ces mauvaises nouvelles: parce que la nature du processus de vieillissement dégénératif dans le système reproducteur n’est pas différente du vieillissement du reste du corps au niveau cellulaire et moléculaire, l’heuristique de « réparation des dommages » de la biotechnologie du rajeunissement peut être appliqué pour rajeunir le système reproducteur vieillissant tout comme il le peut au rajeunissement du reste de notre corps.
Nous n’allons pas résoudre le processus de vieillissement dégénératif en empruntant des astuces spéciales à l’ovocyte. L’ovocyte n’ a pas vraiment d’astuces pour que nous puissions l’exploiter de façon rentable – et plus important encore, aucune cellule du corps n’est naturellement capable d’éliminer ou de réparer les nombreux types de dommages qui s’accumulent dans les corps vieillissants et qui finissent par mener à des maladies liées à l’âge, à la démence et à la mort. L’ovocyte n’ a aucun moyen de dégager les bêta-amyloïdes des cerveaux vieillissants, ou les amyloïdes TTR des cœurs vieillissants – ni de séparer les liaisons croisées d’AGE des artères vieillissantes, car elles ne sont sujettes à aucun de ces dommages. Il n’ a pas de moyens internes pour remplacer les cellules perdues à cause du vieillissement, et il n’est pas plus capable de dégrader les agrégats intracellulaires vraiment têtus qui s’accumulent dans les cellules vieillissantes que n’importe quel autre type de cellule. Pour cela, nous avons besoin d’une nouvelle classe de médicaments qui peuvent faire ce que nous ne pouvons pas faire seuls: enlever, réparer, remplacer ou rendre inoffensifs les dommages cellulaires et moléculaires causés par le vieillissement de nos tissus. C’est en développant des biotechnologies de rajeunissement et en les déployant de façon exhaustive que nous pourrons enfin » retourner en arrière » efficacement pour l’ensemble des organismes vieillissants.
La sénescence cellulaire et le déclin des cellules souches dans l’hypertrophie cardiaque liée à l’âge et causée par l’hypertension artérielle
La sénescence cellulaire est l’une des causes du vieillissement; les cellules sénescentes s’accumulent dans les tissus et leurs signaux inflammatoires et perturbateurs causent des dommages considérables. L’intérêt pour les cellules sénescentes dans le milieu de la recherche s’étant accru rapidement au cours des dernières années, beaucoup d’efforts sont maintenant déployés pour mieux comprendre comment la sénescence cellulaire s’inscrit dans les connaissances actuelles sur la biochimie des affections liées à l’âge. Puisque les cellules sénescentes sont une cause d’inflammation chronique, et puisque l’inflammation et le stress oxydatif vont de pair, presque n’importe quelle condition dans laquelle l’inflammation ou le stress oxydatif se manifestent en évidence est un bon candidat pour le réexamen.
Récemment, des preuves ont émergé selon lesquelles les cellules sénescentes seraient impliquées dans la croissance et l’affaiblissement du muscle cardiaque selon les augmentations de la tension artérielle liées à l’âge, soit l’hypertension. L’hypertension artérielle se produit parce que le durcissement des vaisseaux sanguins et le dysfonctionnement du muscle des parois des vaisseaux sanguins brise le système de rétroaction complexe qui contrôle la tension artérielle. Les conséquences incluent des dommages aux tissus délicats, tels que ceux du cerveau et des reins, comme la rupture de petits vaisseaux à un rythme accéléré, et la restructuration susmentionnée du muscle cardiaque. Le cœur devient plus grand et plus faible. Mais pourquoi? L’article qui suit porte sur le stress oxydatif et les cellules sénescentes des cellules souches cardiaques qui se produisent chez les rats conçus pour développer de l’hypertension.
Dans les coeurs humains, il y a 0,5 à 1 % du chiffre d’affaires annuel des myocytes, en envisageant le rôle des cellules souches cardiaques (CSC) dans le maintien de l’homéostasie du tissu cardiaque. Les CSC différencient et remplacent les myocytes perdus et, en cas de lésion du myocarde, les cellules souches contribuent à la réparation tissulaire. On a spéculé sur l’implication des cellules souches dans l’insuffisance cardiaque associée à l’âge et à la maladie. Cependant, la variation temporelle de la densité et de l’efficacité des cellules souches cardiaques et l’effet de la maladie sur les caractéristiques des cellules souches n’ont pas été analysés de façon systématique.
L’hypertrophie cardiaque est reconnue comme un facteur de risque indépendant d’insuffisance cardiaque. La prise en charge efficace des maladies cardiaques hypertensives exige l’identification des facteurs qui peuvent éventuellement faciliter la transition de l’hypertrophie à l’insuffisance cardiaque. La diminution de la proportion de cellules souches cardiaques saines (CSC) peut affecter la régénération tissulaire. Dans des conditions pathologiques, outre le vieillissement naturel, un microenvironnement défavorable peut entraîner une diminution de l’efficacité des CSC. Cette étude a été conçue dans le but d’examiner la variation associée à l’âge des attributs des cellules souches chez les rats hypertendus spontanément (SHR) par rapport aux rats Wistar normotendus. Le modèle expérimental a été utilisé chez le rat hypertendu spontanément, car le remodelage cardiaque ressemble à l’évolution clinique de la maladie cardiaque hypertensive.
Les dommages à l’ADN et la proportion de CSC sénescentes ont augmenté avec l’âge chez les rats SHR et Wistar. On a observé une augmentation du stress oxydatif associé à l’âge dans le stress oxydatif des cellules souches, probablement liée au stress oxydatif accru dans le microenvironnement. Les changements ont été plus marqués chez les SHR, et dès l’âge de six mois, l’efficacité des CSC des SHR a considérablement diminué par rapport aux Wistar. La densité de CSC saines, déterminée comme fraction des cellules différenciées, était remarquablement faible chez les SHR de 18 mois. La diminution liée à l’âge des CSC fonctionnellement efficientes a donc été accélérée chez les SHR.
L’expression des marqueurs associés à la sénescence p21 et p16ink4a et la proportion de cellules SA-β -gal positives augmentent avec l’âge. La proportion de cellules sénescentes était significativement plus élevée chez les rats SHR que chez les rats Wistar appariés selon l’âge. La sénescence et la mort des SCS avec l’augmentation de l’âge chez les souris de type sauvage ont été mises en cause dans une altération de la croissance et le renouvellement des cellules du cœur. Les cellules souches sénescentes agissent sur leur microenvironnement en diminuant le potentiel régénérateur de l’ensemble des cellules souches, tout en affectant les myocytes et le système vasculaire avoisinants. Cette étude rapporte pour la première fois l’expression accrue de p16ink4a et p21 dans les CSC avec l’âge et sa prépondérance dans la RSS. La différence entre SHR et Wistar est apparue dès l’âge de 6 mois, qui est la phase compensatoire de l’hypertrophie.
En conclusion, la diminution de l’efficacité des cellules souches liée à l’âge peut être responsable des changements cardiaques dégénératifs du vieillissement physiologique. Le vieillissement des CCF peut influer sur la migration et la prolifération et favoriser l’apoptose. Le vieillissement accéléré dans les cellules souches isolées à partir des coeurs de SHR est probablement médié par un microenvironnement défavorable. La diminution du nombre de cellules souches saines peut nuire à l’efficacité de la réparation tissulaire et précipiter le passage de l’hypertrophie compensée à l’insuffisance cardiaque. Le stress oxydatif accru dans le microenvironnement peut être un facteur prédominant qui contribue au vieillissement des cellules souches. Les résultats marquants du déclin accéléré de l’efficacité des cellules souches cardiaques dans la RSS permettent de mieux comprendre les résultats d’autres études visant à déterminer si la réduction du stress oxydatif cardiaque peut rétablir la fonction des cellules souches et prévenir le remodelage cardiaque progressif.
Traduit avec www.DeepL.com/Translator













 La fondation SENS commente la recherche de Calico sur le rajeunissement apparent des ovocytes
La fondation SENS commente la recherche de Calico sur le rajeunissement apparent des ovocytes





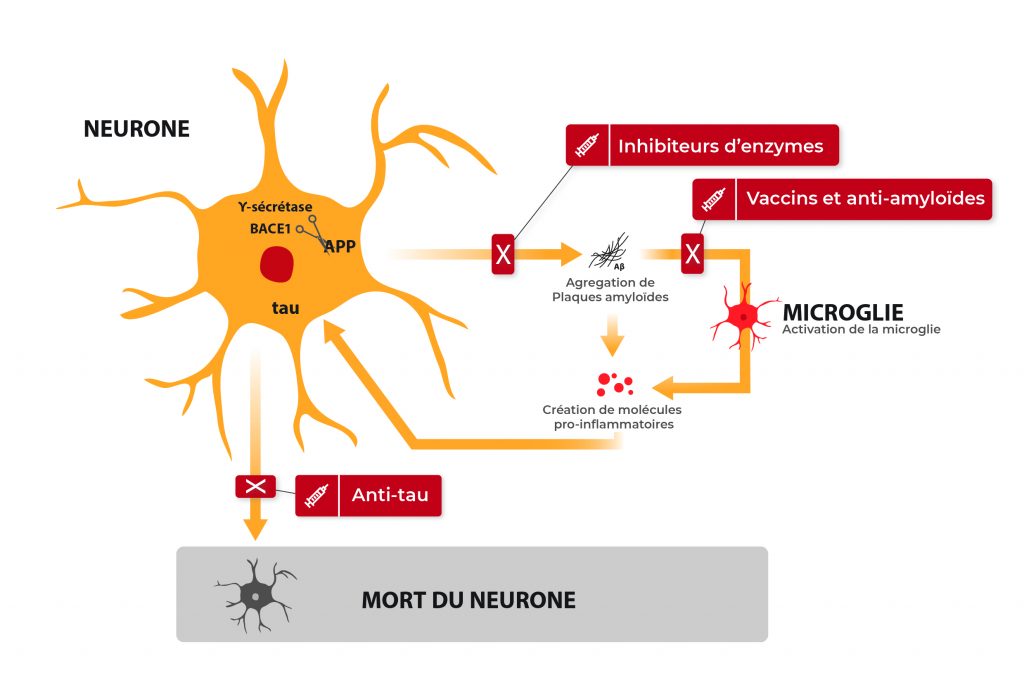




 La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !
La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !