L’hypothalamus, une nouvelle piste contre le vieillissement ?
Des chercheurs de l’Albert Einstein College of Medecine de New York ont réussi à prouver que l’hypothalamus, une partie du cerveau située dans le système nerveux central, déjà connu pour son rôle dans la croissance et le développement, est grandement responsable du vieillissement. Son étude serait donc un facteur clé pour lutter contre ce phénomène.
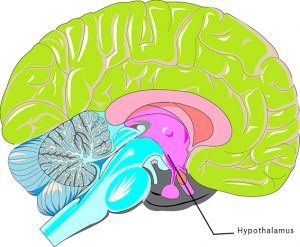
Dans cette étude, des hypothalamus de souris ont été étudiés, notamment pour sa réponse immunitaire : il est en effet déjà connu pour son rôle dans l’apparition de symptômes tels que la prise de poids ou l’hypertension, symptômes également associés au vieillissement. De précédentes études avaient prouvé qu’une protéine, la NFkB, et sa kinase modulatrice IKKB, étaient responsables de la réponse immunitaire de l’hypothalamus. En observant des souris d’âges différents, les chercheurs ont remarqué que NFkB n’était pas active dans les hypothalamus des jeunes souris, mais qu’elle commençait à le devenir pour les souris d’âge moyen et que plus la souris était âgée, plus cette protéine était activée.
Par la même occasion, l’équipe a cherché à établir si l’inhibition de NFKb et IKKB pouvait provoquer un effet « anti-âge», ce qu’ils ont été en mesure de prouver après diverses expérimentations d’activation/inhibition de ces deux protéines. En poussant les expériences sur ces activations, les chercheurs ont découvert qu’elles provoquaient en parallèle l’inhibition d’une hormone, la GnRH, dont le rôle est de réguler les hormones sexuelles et la reproduction. Il a donc fallu étudier si cette hormone, liée à NF-kB/IKKB, était responsable du vieillissement.
En injectant de la GnRH dans des souris âgées, les chercheurs en sont arrivés à la conclusion surprenante qu’elle était responsable de la neurogenèse (formation de nouveaux neurones) et ce quel que soit l’âge. Or, le vieillissement est caractérisé, entre autres, par un ralentissement de la neurogenèse ; la GnRH ralentirait donc le vieillissement via la modulation de ce phénomène [1].
Puis, en 2017, ces mêmes chercheurs ont identifié des cellules souches, qui chez la souris âgée, étaient de moins en moins présentes. Afin de mieux comprendre leur rôle dans le vieillissement, les cellules souches ont été retirées chez des modèles de souris, donnant lieu à des résultats sans appel : ces souris vieillissaient beaucoup plus vite et mourraient beaucoup plus rapidement qu’à la normale. L’explication favorisée par l’équipe a été la suivante : les molécules relâchées par ces cellules souches via des exosomes, de petits ARN non codants appelées microRNA (miRNAs), avaient un effet sur le vieillissement. De manière intéressante, lorsque les chercheurs ont injecté ces exosomes directement dans les hypothalamus de deux types de souris (avec des cellules souches et sans cellules souches) d’âge moyen, le vieillissement a été ralenti de manière significative tant sur le plan physique (analyse des tissus, endurance musculaire et coordination) que comportemental (comportement social et capacités cognitives) [2].
En conclusion, ces études ont permis de prouver en étudiant l’hypothalamus qu’il était au cœur de prometteuses pistes pour la lutte contre le vieillissement: inhiber les protéines NF-kB/IKKB afin de maintenir une production de l’hormone GnRh, et comprendre le mode d’action des miRNAs contenus dans les cellules souches permettrait de ralentir le vieillissement.
Sources :
[1] Guo Zhang, Juxue Li, Sudarshana Purkayastha, Yizhe Tang, Hai Zhang, Ye Yin, Bo Li, Gang Liu, and Dongsheng Cai (2013). Hypothalamic programing of systemic aging involving IKKB/NF-kB and GnRH. Nature.
[2] Yalin Zhang, Min Soo Kim, Baosen Jia, Jingqi Yan, Juan Pablo Zuniga-Hertz, Cheng Han and Dongsheng Cai (2017). Hypothalamic stem cells control ageing speed partly through exosomal miRNAs. Nature.
Arthur Michaud

Author
Auteur
Arthur studies biotechnological engineering at Sup’Biotech.
More about the Long Long Life team
Arthur étudie l’ingénierie des biotechnologies à Sup’Biotech.
En savoir plus sur l’équipe de Long Long Life





 La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !
La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !