L’influence de la télomérase sur les télomères et le vieillissement
Accélération du vieillissement dues aux mutations de la télomérase
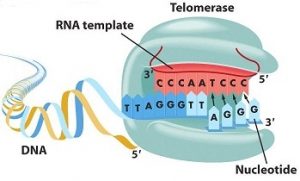
La télomérase est l’enzyme chargée de synthétiser les télomères. Elle provoque l’addition des répétitions TTAGGG aux extrémités chromosomiques et permet de reconstituer le télomère. Elle est constituée d’une sous-unité protéique, TERT (Telomerase reverse transcriptase), en charge de la synthèse télomérique ainsi que d’une sous-unité ARN, TERC (Telomerase RNA component), utilisée comme modèle de synthèse [1].
Différentes études ont été menées sur des souris ne disposant plus du gène codant la sous-unité TERC. L’objectif était de déterminer l’impact du raccourcissement des télomères sur le processus de vieillissement et sur l’apparition du cancer. Il a alors été découvert qu’en l’absence de ce gène, la viabilité sur le long terme de ces souris était fortement compromise [2]. Concernant le groupe de souris ayant survécu, de nombreux symptômes associés à la perte de répétitions télomériques ont été observés : la perte de fertilité, des défaillances cardiaques, de l’immuno-senescence (soit une détérioration progressive du système immunitaire causée par le processus de vieillissement), une diminution du taux de renouvellement des cellules du système digestif, de la peau et du système hématopoïétique (système de renouvellement des globules présents dans le sang)… [2]. Or l’ensemble de ces symptômes apparaissent généralement avec l’âge et confirment le lien existant entre le vieillissement et les dysfonctionnements de la télomérase.
Les télomères ainsi que la télomérase semblent avoir un impact sur les processus de vieillissement. En effet, il a été observé que les mutations, affectant tout composant de la télomérase, entraînent des troubles, tels que la dyskératose congénitale, l’anémie aplasique, les syndromes myélodysplasiques et des leucémies [1]. Ces pathologies ont pour point commun de se manifester par un mauvais renouvellement cellulaire et une dégénération importante des tissus, des signes généralement associés au vieillissement [1]. Si les mécanismes exacts ne sont pas encore totalement élucidés, la télomérase semble cependant jouer un rôle important dans le processus de vieillissement et sur la durée de vie.

De nombreuses pathologies associées au vieillissement dues aux mutations de la télomérase
L’étude des maladies humaines associées à des mutations des composants de la télomérase a été le point de départ de la découverte du rôle limitant des télomères sur la longévité et de l’impact de la télomérase sur le vieillissement.
Dans de précédents articles (voir : Les télomères : au cœur des processus de vieillissement), il a été mentionné que la longueur télomérique serait en mesure de prédire l’apparition de sénescence réplicative, soit un état permanent d’arrêt du cycle. Des altérations des télomères sont alors associées à une diminution des métabolismes cellulaires. L’accumulation de ce type de cellules dans un organisme entrainerait alors la manifestation de phénotypes liés à l’âge sous forme de diverses pathologies [1].
Les maladies cardiovasculaires
L’insuffisance cardiaque est l’une des causes majeures de mort prématurée chez les personnes âgées. Des chercheurs ont donc étudié le lien entre le raccourcissement des télomères, qui s’accélère avec l’âge, et le développement de troubles cardiaques. Ils ont analysé la fonction cardiaque chez des souris dont le gène codant pour la télomérase a été invalidé dans les cellules souches embryonnaires. Chez plusieurs générations de ces souris TERC (-/-), une diminution importante de l’espérance de vie a été observée due au raccourcissement des télomères, qui serait couplé à une diminution de la prolifération cellulaire, une augmentation de l’apoptose et de l’hypertrophie (augmentation trop importante du volume des cellules musculaires cardiaques) [3]. En réponse à ces effets, une dilatation ventriculaire, des parois vasculaires plus fines et des dysfonctionnements cardiaques ont été observés [3].
Ainsi l’accélération de la vitesse de raccourcissement des télomères due à un mauvais fonctionnement de la télomérase serait associée à des maladies liées au vieillissement telles que les maladies cardiovasculaires. De surcroît, d’autres études ont démonté qu’il existait une corrélation entre le raccourcissement des télomères et la mort prématurée due à une maladie cardiovasculaire ou à une infection [4]. De ce fait, en partant de l’hypothèse qu’il y aurait des problèmes de régulation de la télomérase chez l’homme au cours du vieillissement, l’ensemble de ces informations pourraient ouvrir la voie vers des thérapies préventives innovantes contre l’apparition de ces maladies cardiovasculaires.
Démence et désordres cognitifs

Des chercheurs ont démontré qu’il existerait une corrélation entre le raccourcissement des télomères et l’apparitions de troubles mentaux : l’augmentation du stress perçu, le développement de troubles cognitifs et d’état dépressif [5]. De plus, chez des personnes subissant un raccourcissement accéléré des télomères du à un dysfonctionnement de la télomérase, le développement de cas de schizophrénie et de troubles de l’humeur a également été observé [6]. Ces différents désordres cérébraux, qui se développent fréquemment avec l’âge, confirment le rôle central de la télomérase et des télomères au sein des processus de vieillissement.
Mauvais renouvellement cellulaire et dégradation des tissus
Parmi les pathologies associées aux mutations de TERC, on retrouve des maladies entraînant un mauvais renouvellement des cellules. C’est, par exemple, le cas de la dyskératose congénitale, également appelée téloméropathie. En effet, elle se manifeste par une dégradation très rapide des télomères. Si les signes cliniques sont très nombreux, les atteintes les plus sévères sont : l’aplasie médullaire (raréfaction de moëlle osseuse), la neutropénie (diminution de la quantité de certains globules blancs, les polynucléaires neutrophiles), la thrombopénie (diminution des plaquettes), la fibrose pulmonaire, le déficit immunitaire global et la survenue de cancer. Il n’existe pas à l’heure actuelle de traitement spécifique pour cette maladie, si ce n’est la transplantation de cellules souches hématopoïétiques, qui semble avoir des effets positifs [2].
Ces mutations des composants de la télomérase participent à la dégradation de l’organisme à tous les niveaux : mauvais renouvellement cellulaire, dérèglement des systèmes de protection et de réparation de l’organisme, dégénérescence des tissus, etc [2]. Les pathologies qui y sont associées sont nombreuses. On retrouve l’anémie aplasique qui se caractérise par un nombre de globules rouges dans le sang trop bas ou encore la fibrose pulmonaire idiopathique qui est une maladie mortelle caractérisée par une scarification des poumons entraînant des désordres respiratoires.
L’origine des dysfonctionnements de la télomérase et de l’accélération du vieillissement
Si les effets de ces mutations de la télomérase sont très variables d’un individu à l’autre, ils ont pour point commun d’être associés à des défauts de renouvellement des cellules et de régénération des tissus. Ils contribuent au développement de phénotypes comparables aux signes de vieillissement.
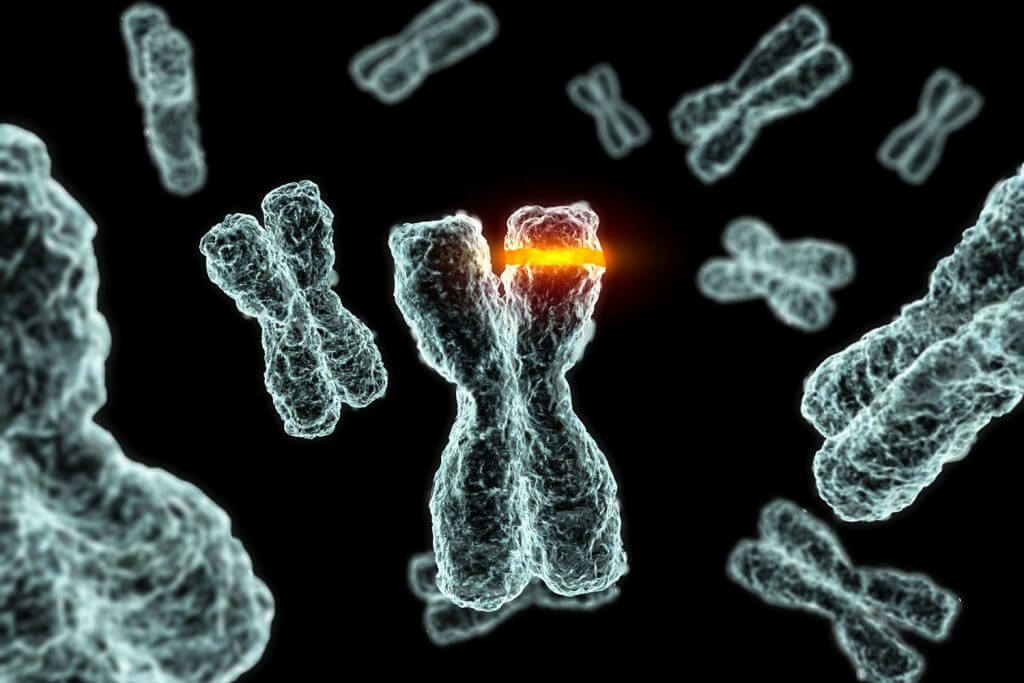
Les télomères sont indispensables au maintien du cycle cellulaire. Cependant, s’il a été démontré qu’un dérèglement de l’activité enzymatique de la télomérase peut accélérer le vieillissement, une surexpression de cette enzyme pourrait induire une prolifération excessive des cellules et donc potentiellement augmenter le risque de développer des tumeurs [2]. De ce fait, concernant de futures pistes thérapeutiques, il serait intéressant de s’orienter vers des traitements ciblés. Une thérapie sur les télomères ciblant uniquement les cellules souches permettrait de palier au problème de renouvellement cellulaire avec l’âge sans risquer d’induire le développement de cancer dans l’ensemble de l’organisme (Cf : Partie 3 : Télomère et télomérase dans les cellules souches : indispensables durant le vieillissement).
Tous les articles de notre dossier « Télomères et vieillissement » :
Les télomères : au cœur des processus de vieillissement
 Le raccourcissement des télomères est connu pour avoir une influence sur le vieillissement sans que cela ne soit pleinement explicité. Mais comment fonctionnent-ils ? Sur quels mécanismes biologiques agissent-ils ? Et pourquoi les qualifier d’ « horloges biologiques » de notre corps ?
Le raccourcissement des télomères est connu pour avoir une influence sur le vieillissement sans que cela ne soit pleinement explicité. Mais comment fonctionnent-ils ? Sur quels mécanismes biologiques agissent-ils ? Et pourquoi les qualifier d’ « horloges biologiques » de notre corps ?
Partie 1 : Causes et effets du raccourcissement des télomères au cours du vieillissement
 La vitesse de raccourcissement des télomères et le vieillissement varient d’un individu à l’autre, sans que cela ne soit encore pleinement clarifié. En effet, les causes qui pourraient expliquer les différences de longueur de télomères sont très variées.
La vitesse de raccourcissement des télomères et le vieillissement varient d’un individu à l’autre, sans que cela ne soit encore pleinement clarifié. En effet, les causes qui pourraient expliquer les différences de longueur de télomères sont très variées.
Partie 2 : L’influence de la télomérase sur les télomères et le vieillissement
 La longueur des télomères et la télomérase semblent être des facteurs clés du processus de vieillissement. De nombreuses études sur les maladies dues à des mutations des composants de la télomérase ont démontré que cela entraîne un mauvais renouvellement des cellules, soit l’un des phénotypes liés à l’âge.
La longueur des télomères et la télomérase semblent être des facteurs clés du processus de vieillissement. De nombreuses études sur les maladies dues à des mutations des composants de la télomérase ont démontré que cela entraîne un mauvais renouvellement des cellules, soit l’un des phénotypes liés à l’âge.
 L’expression de la télomérase est diminuée quelques semaines après la naissance dans la majorité des tissus adultes, à l’exception de certains types cellulaires, telles que les cellules souches. On peut alors se demander s’il existe un lien entre la diminution du stock de cellules souches avec l’âge, le fonctionnement de la télomérase et la longueur des télomères.
L’expression de la télomérase est diminuée quelques semaines après la naissance dans la majorité des tissus adultes, à l’exception de certains types cellulaires, telles que les cellules souches. On peut alors se demander s’il existe un lien entre la diminution du stock de cellules souches avec l’âge, le fonctionnement de la télomérase et la longueur des télomères.
Partie 4 : Vers une métrologie du vieillissement à partir du télomère
 Des méthodes de métrologie du vieillissement se basant sur la longueur des télomères ont été développée. Aujourd’hui, on en dénombre 5 principales, dont TAT ou STELA. Elles permettent toutes, à partir de la longueur des télomères, de fournir des indications précieuses sur l’avancement de l’âge physiologique ainsi que sur le vieillissement.
Des méthodes de métrologie du vieillissement se basant sur la longueur des télomères ont été développée. Aujourd’hui, on en dénombre 5 principales, dont TAT ou STELA. Elles permettent toutes, à partir de la longueur des télomères, de fournir des indications précieuses sur l’avancement de l’âge physiologique ainsi que sur le vieillissement.
Partie 5 : Télomères, vieillissement et thérapies
 La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !
La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !
Katidja Allaoui

Author
Auteure
Katidja studied biology and health engineering at the school of engineering of Angers.
More about the Long Long Life team
Katidja a étudié l’ingénierie de la biologie et de la santé à l’école d’ingénieurs de l’université d’Angers.
En savoir plus sur l’équipe de Long Long Life
Dr Guilhem Velvé Casquillas

Author/Reviewer
Auteur/Relecteur
Physics PhD, CEO NBIC Valley, CEO Long Long Life, CEO Elvesys Microfluidic Innovation Center
More about the Long Long Life team
Docteur en physique, CEO NBIC Valley, CEO Long Long Life, CEO Elvesys Microfluidic Innovation Center
En savoir plus sur l’équipe de Long Long Life
Sources :
[1] Chatterjee, S. (2017). Telomeres in health and disease. Journal of oral and maxillofacial pathology: JOMFP, 21(1), 87.
[2] Blasco, M. A. (2007). Telomere length, stem cells and aging. Nature chemical biology, 3(10), 640-649.
[3] Leri, A., Franco, S., Zacheo, A., Barlucchi, L., Chimenti, S., Limana, F., … & Blasco, M. A. (2003). Ablation of telomerase and telomere loss leads to cardiac dilatation and heart failure associated with p53 upregulation. The EMBO journal, 22(1), 131-139.
[4] Cawthon, R. M., Smith, K. R., O’Brien, E., Sivatchenko, A., & Kerber, R. A. (2003). Association between telomere length in blood and mortality in people aged 60 years or older. The Lancet, 361(9355), 393-395.
[5] Canela, A., Vera, E., Klatt, P. & Blasco, M.A. High-thoughput telomere length quantification by FISH and its application to human population studies. Proc. Natl. Acad. Sci. USA 104, 5300–5305 (2007).
[6] Teyssier, J. R., Ragot, S., Donzel, A., & Chauvet-Gelinier, J. C. (2010). Longueur des télomères dans le cortex des patients atteints de troubles dépressifs. L’Encéphale, 36(6), 491-494.
*https://planet-vie.ens.fr/article/1813/invalidation-gene-knock-out